Date: July 2020
Kontaktieren Sie das wissenschaftliche Team für präklinische Onkologie, um mehr zu erfahren.
In February, we presented initial data of Labcorp's emerging humanized mouse platform utilizing human peripheral blood mononuclear cell (hPBMC) engraftment.
Our data using the NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ (NSG) mouse resulted in identification of four hPBMC donors that exhibited a treatment window of at least 30 days post hPBMC injection, consistent T cell engraftment, and growth of two human xenograft models, MiaPaCa-2 (pancreatic) and A549 (NSCLC), that was robust in hPBMC-engrafted NSG mice.
Wir präsentieren nun erste Wirksamkeitsdaten, die die Verwendung von hPBMC-implantierten NSG-Mäusen mit MiaPaCa-2 oder A549 humanen Xenografts nach der Behandlung mit Pembrolizumab (Keytruda®, Anti-hPD-1) zeigen.
Experimentelles Design
Ziel dieser Studien war die Evaluierung der Anti-Tumor-Antwort von Pembrolizumab gegen die menschlichen Tumormodelle MiaPaCa-2 oder A549 nach der Implantation von hPBMC in NSG-Mäuse. Die Pflege und Nutzung der Tiere fand gemäß dem Handbuch für die Pflege und Nutzung von Labortieren fand in einer von AAALAC akkreditierten Einrichtung statt.
NSG-Mäusen (Jackson Laboratories, Bar Harbor Maine, USA, Stamm #0005557) wurde nach Tumoretablierung (~105–118 mm3) von drei verschiedenen normalen gesunden Spendern (Hemacare, Los Angeles CA, USA) intravenös hPBMC verabreicht. Die Behandlung mit Pembrolizumab begann am Tag nach der hPBMC-Injektion. Response to pembrolizumab, evaluation of onset of Graft vs. Host Disease (GvHD)-like characteristics were determined, and whole blood was collected at two timepoints for flow cytometry analysis of human lymphocyte markers to confirm donor engraftment of CD45+ cells, including CD4+ and CD8+ T cells.
MiaPaCa-2 und A549/Kontrolltumorwachstums bei Mäusen, in die HPBMC transplantiert wurde
Die MiaPaCa-2-Tumorverdopplungszeit (Td) bei unbehandelten Kontrolltieren betrug ~7 Tage, bei Tieren, denen hPBMC verabreicht wurden, reichte die Td bei jeder Spendergruppe von ~5 bis zu 7 Tagen.
Die Tumoren wuchsen gleichmäßig bis zu einem mittleren Tumorvolumen von 1000–1200 mm3 an Tag 36 bei allen drei Spendern, wobei jedoch über Tag 36 hinaus eine gewisse gruppeninterne und gruppenübergreifende Variabilität zu beobachten war. Das Tumorwachstum vor 1000 mm3 schien durch das hPBMC-Engraftment nicht beeinflusst zu werden (Abbildung 1).
Diese Ergebnisse deuten darauf hin, dass der Einsatz eines dieser drei Spender für MiaPaCa-2-Wirksamkeitsstudien mit einer Größe von 1000 mm3 für die Zeit bis zur Evaluierung (TES) geeignet wäre.
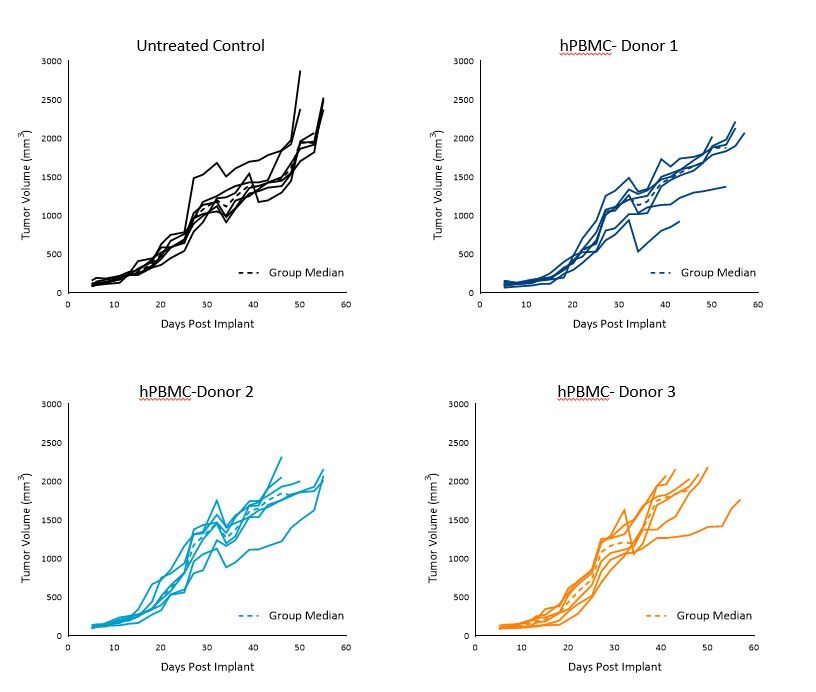
Abbildung 1. Kontrolle des Wachstums von MiaPaCa-2 subkutanen Tumoren nach Verabreichung von hPBMC
A549 Td bei unbehandelten Kontrolltieren betrug ~11 Tage, Td bei Tieren, denen hPBMC verabreicht wurden, reichte von 9 bis 12 Tagen in jeder Spendergruppe.
Die Tumoren wuchsen gleichmäßig mit hPBMC von Spendern 1 und 3 auf ein mittleres Tumorvolumen von 1000–1200 mm3 an Tag 40 mit einer gewissen Variabilität im Wachstum über den Tag 40 hinaus.
Die gruppeninterne Variabilität war am deutlichsten bei den Mäusen mit A549-Tumoren und hPBMC von Spender 2 (Abbildung 2).
These results suggest that donors 1 and 3 are most suitable for A549 efficacy studies with a TES of 1000mm3.
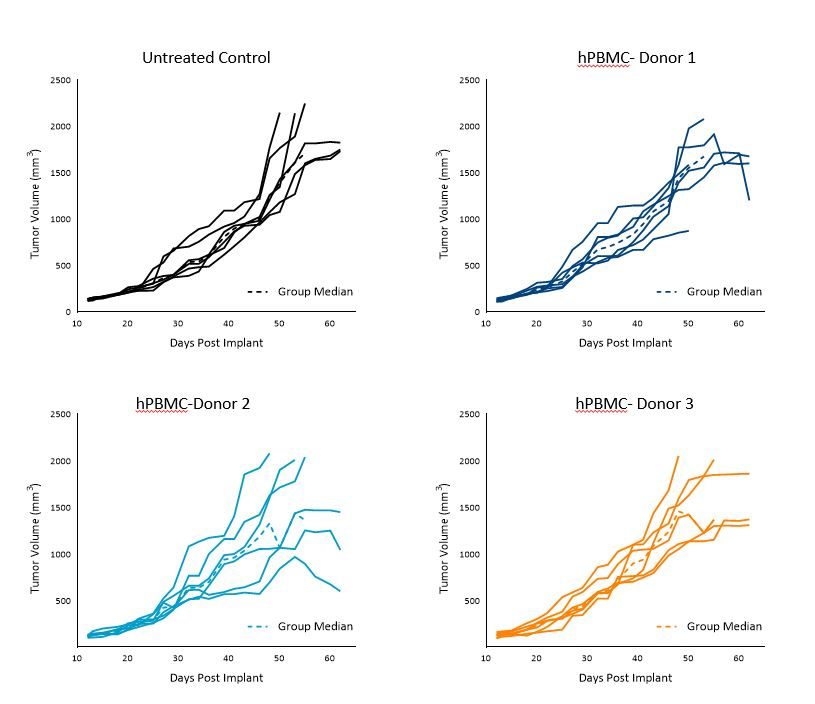
Abbildung 2. Kontrolle des Wachstums von subkutanen A549-Tumoren nach hPBMC-Verabreichung
Implantation und Beständigkeit von menschlichen Lymphozyten
Die Einbringung wurde an Tag 28 und entweder an Tag 38 (MiaPaCa-2) oder Tag 42 (A549) nach hPBMC-Verabreichung durch immunphänotypische Analyse von menschlichen Immunzellmarkern im peripheren Blut von Studienmäusen bewertet.
Zu den Durchflusszytometrie-Markern gehörten mCD45, hCD45, hCD3, hCD4 und hCD8. Human CD45+ cells, as a percentage of live cells from animals harboring either MiaPaCa-2 (Figure 3A) or A549 tumors (Figure 3B), are presented below and were used as an indicator of hPBMC engraftment.
We found that hCD45+ cells in whole blood were detected across all donors at both timepoints and were in line with published literature.1
Während die Variabilität innerhalb der Gruppe offensichtlich war, blieb der durchschnittliche Umfang des Engraftments zwischen dem ersten und zweiten Zeitpunkt konstant oder nahm zu. Es zeigte sich, dass das hPBMC-Engraftment bei Tieren, die A-549-Tumoren beherbergen, etwas höher war als bei Tieren, die MiaPaCa-2-Tumoren beherbergen, und dies stimmte mit unseren anfänglichen Modellentwicklungsdaten überein.
Derzeit ist nicht bekannt, ob dies das Ergebnis einer normalen Variabilität von Studie zu Studie war oder ob es eine Modellabhängigkeit vom Engraftment gibt.
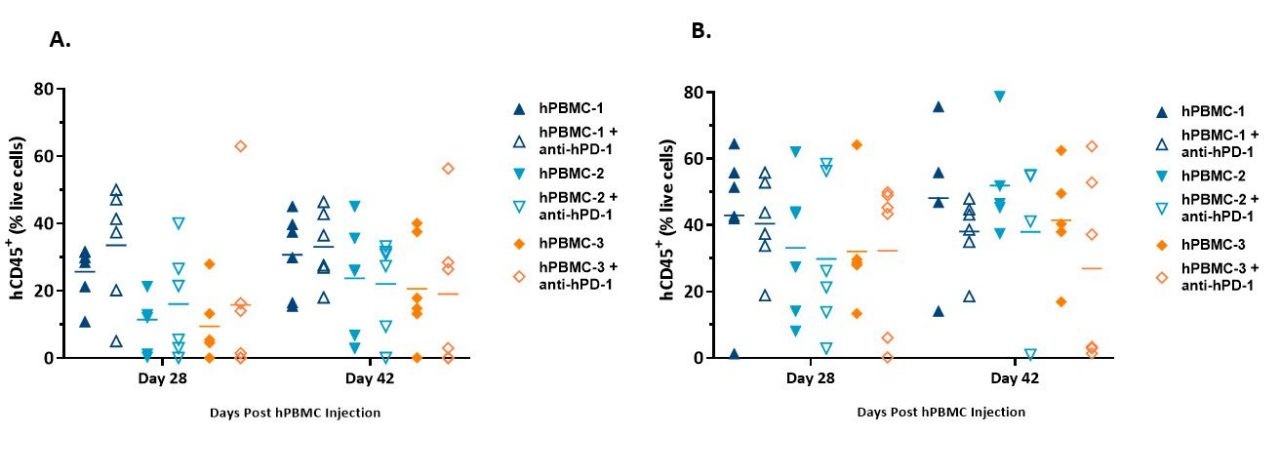
Abbildung 3. Engraftment von hCD45+-Zellen, die im Vollblut von NSG-Mäusen nachgewiesen wurden, denen hPBMC verabreicht wurden und die MiaPaCa-2 beherbergen. (A) oder A549 (B) Xenotransplantate.
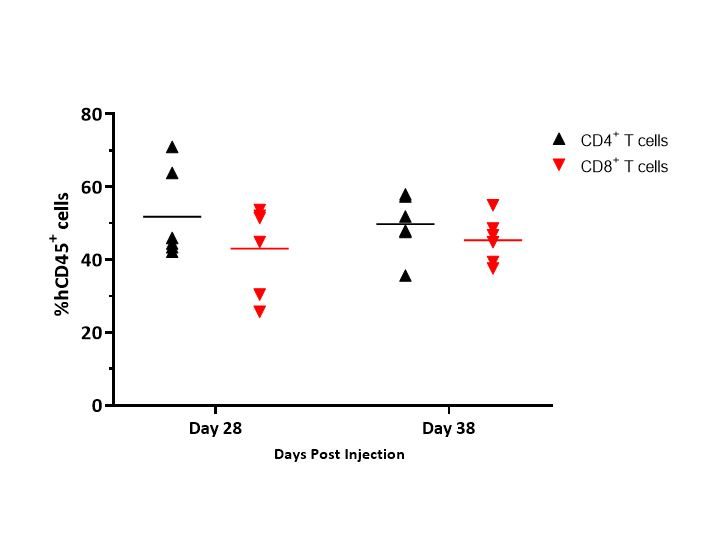
Figure 4 illustrates an example of distribution of CD4+ and CD8+ T cells in whole blood and illustrates that the distribution of T cells was consistent between timepoints.
Diese Daten repräsentieren zwar nur Spender 1 bei Mäusen, die MiaPaCa-2-Tumoren beherbergen, aber ähnliche Daten wurden für alle getesteten Spender und Modelle berichtet.
Specifically, distribution of CD4+ and CD8+ T cells ranged from 42-65 % and 32-46 %, respectively, in MiaPaCa-2-bearing mice, and 51-67 % and 22-44 %, respectively, in A549-bearing mice (data not shown).
Onset of GvHD symptoms was monitored by body weight and clinical observations; though not confirmed pathologically in these studies, symptoms observed in these models are strongly correlated with the disease2 and with previous data (data not shown).
Reaktion auf Pembrolizumab
Interessanterweise hatte die Pembrolizumab-Behandlung in den Mäusen mit hPBMC-Engraftment unter den getesteten Bedingungen bei keinem der Spender Auswirkungen auf das Wachstum von MiaPaCa-2- oder A549-Tumoren (Abbildungen 5 und 6).
Zum Zeitpunkt dieses Artikels gab es nur wenig Literatur bezüglich der in-vivo-Reaktion auf Pembrolizumab in humanisierten Mäusen mit hPBMC-Engraftment, die MiaPaCa-2-Tumoren beherbergten.
Notwithstanding, our data is reflective of a wide literature regarding the refractory nature of pancreatic tumors to immuno-oncology agents.3 Response of pembrolizumab against A549 appears moderate as reported previously, and that response seems to be donor dependent.4
Trotz der beständigen mangelnden Reaktion von Pembrolizumab gegen A549 oder MiaPaCa-2} können sich diese Modelle für therapeutische Ansätze mit rationalen Kombinationsstrategien mit Anti-hPD-1 als nützlich erweisen, da es erheblichen Spielraum für Verbesserungen und die Bewertung unterschiedlicher Reaktionen bei verschiedenen Spendern gibt.
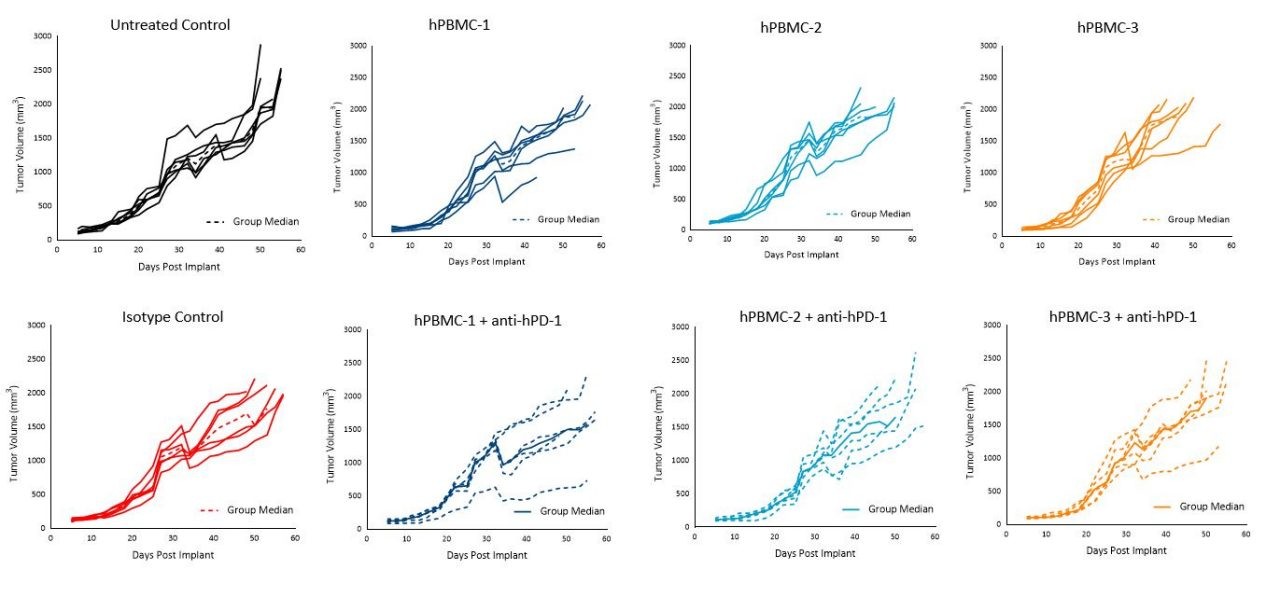
Abbildung 5. Tumorwachstum von MiaPaCa-2 subkutanen Tumoren nach hPBMC-Verabreichung und Behandlung mit Isotypenkontrolle oder Pembrolizumab (anti-hPD-1)
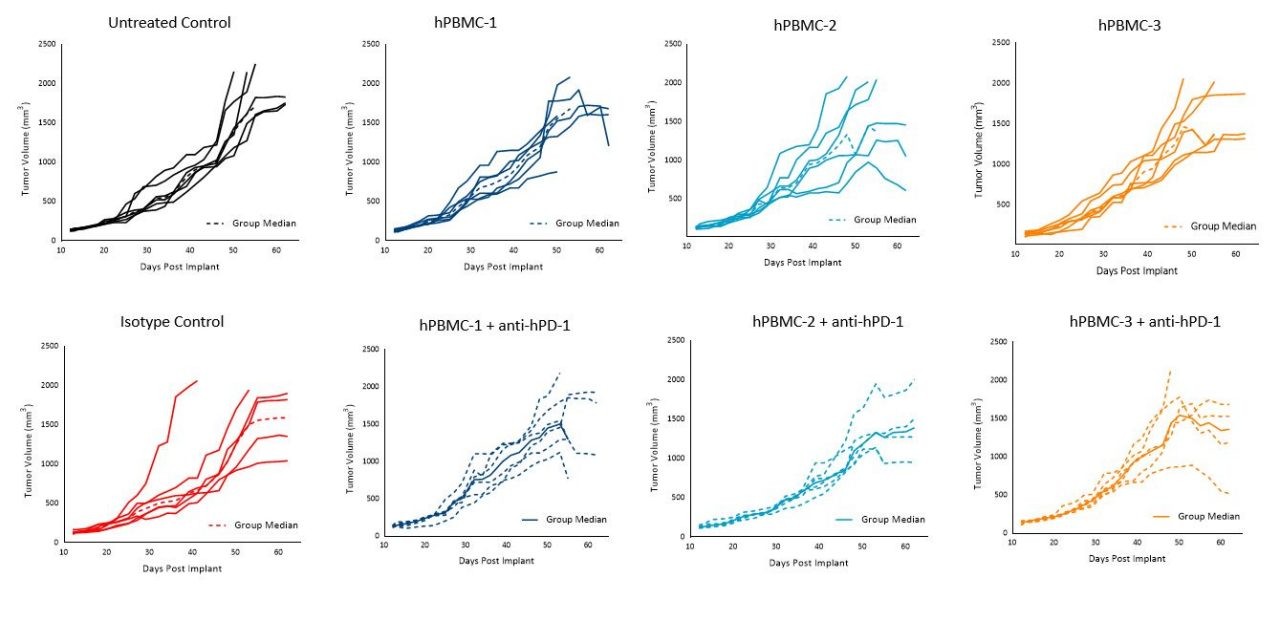
Abbildung 6. Tumorwachstum von subkutanen A549-Tumoren nach hPBMC-Verabreichung und Behandlung mit Isotypenkontrolle oder Pembrolizumab (anti-hPD-1)
Die Verabreichung von hPBMC an NSG-Mäuse führt zur Persistenz von humanen T-Zellen in der Maus mit minimalen Auswirkungen auf das Wachstum von MiaPaCa-2 oder A549-Tumoren. Dieser Ansatz stellt eine leistungsstarke präklinische Plattform dar, um die Auswirkungen neuartiger menschlicher Wirkstoffe zu untersuchen, die menschliche T-Lymphozyten zur direkten Anti-Tumor-Aktivität mit direkter klinischer Bedeutung nutzen.
Zukünftige Arbeiten werden die Infiltration von menschlichen T-Zellen in den Tumor und die Peripherie mittels Durchflusszytometrie unter Behandlung von FDA-zugelassenen Immuntherapien gegen menschliche Tumor-Xenografts in NSG-Mäusen zeigen, die mit hPBMC rekonstituiert wurden.
Labcorp has banked supplies of these human PBMC donors to be available for your research needs. Please contact our preclinical oncology scientists to see how hPBMC-engrafted NSG mice can be used for your next translational immuno-oncology study.
Verweise
1.Todd Pearson, Dale L. Greiner und Leonard D. Shultz. Schaffung „humanisierter“ Mäuse zum Studium der Humanimmunität. 2008. Curr Protoc Immunol Chapter 15: Unit 15,21
2.Sina Naserian, Mathieu Leclerc, Allan Thiolat, Caroline Pilon, Cindy Le Bret, Yazid Belkacemi, Sébastien Maury, Frédéric Charlotte und José L. Cohen. Einfaches, reproduzierbares und effizientes klinisches Einstufungssystem für murine Modelle der akuten Graft-versus-Host-Krankheit. 2018 Front. in Immun. (9): 10.
3.Robert J. Torphy, Yuwen Zhu und Richard D. Schulick. Immuntherapie bei Bauchspeicheldrüsenkrebs: Barrieren und Durchbrüche. 2018. Ann Gastroenterol Surg. 2(4): 274–281.
Unterhalten wir uns
Kontakt