Date: June 2017
Während der direkte Beitrag von CD19 zu menschlichen B-Zell-Karzinomen noch untersucht wird, findet sich seine Expression bei der Mehrzahl der bösartigen B-Zell-Karzinome. Beispielsweise weisen akute lymphoblastische Leukämie (ALL), B-Zell-Lymphome und B-Zell-Leukämien eine CD19-Expression von jeweils 80 %, 88 % und 100 % auf.1 Bei der ALL kommt es zu einer Überproduktion von Lymphoblasten im Knochenmark, die sich kontinuierlich vermehren, was zur Hemmung der normalen hämatopoetischen Zellproduktion führt.
ALL kommt häufiger bei kleinen Kindern vor, tritt aber auch bei älteren Erwachsenen auf. Kinder haben eine über 80 % liegende Heilungsrate, während Erwachsene nur eine 20 bis 30 %ige Heilungsrate haben. Eine ähnliche Krankheit ist die chronische lymphatische Leukämie (CLL), die im Allgemeinen bei älteren Erwachsenen diagnostiziert wird. Sowohl ALL als auch CLL wurden als Malignome identifiziert, die für CD19-geleitete Therapien geeignet sind. Während monoklonale Anti-CD19-Antikörper und andere Ansätze für die klinische Entwicklung untersucht werden, sind der bei weitem häufigste Ansatz zur Bekämpfung CD19-verwandter Malignome die mit dem chimären Antigenrezeptor (CAR) modifizierten T-Zellen (CAR-T). CD19 war das erste Ziel, das für diese T-Zell-Therapie-Strategie verwendet wurde, und ist immer noch ein Bereich aktiver klinischer Untersuchungen.
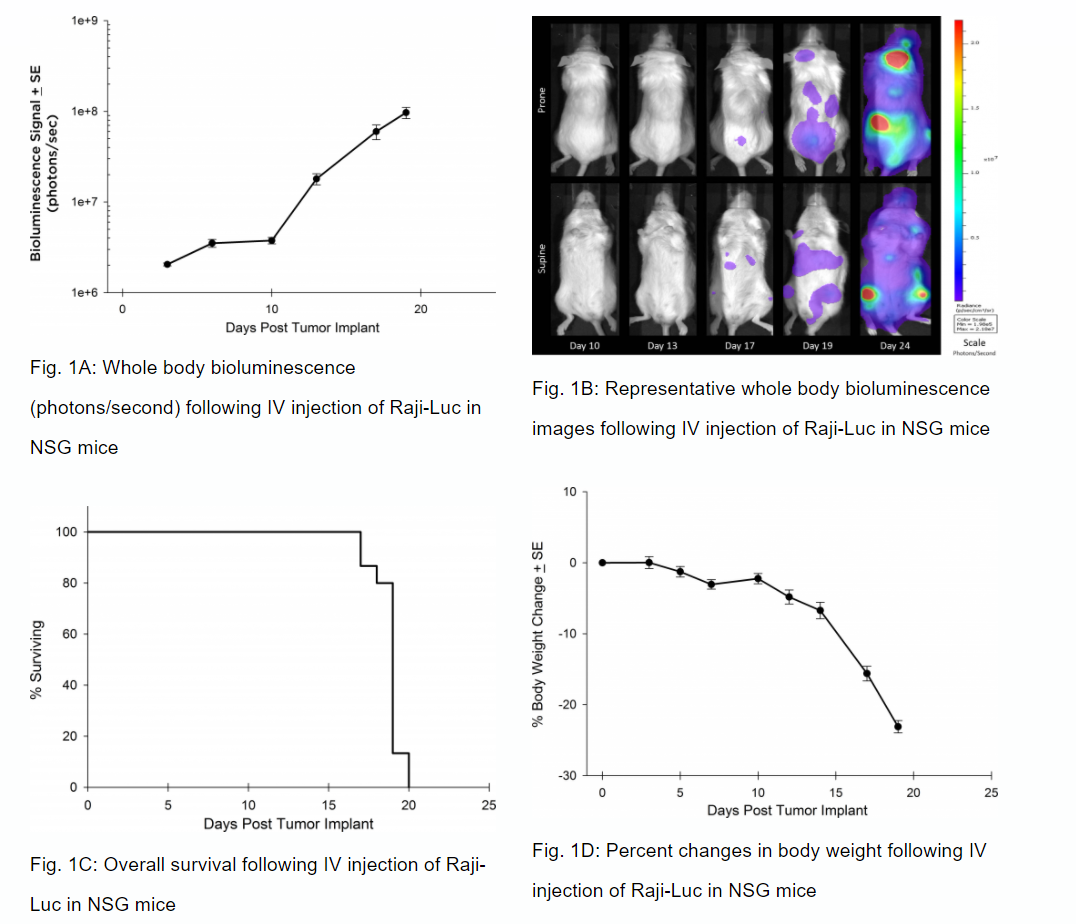
Präklinisch war die menschliche Burkitt-Lymphom-Zelllinie Raji eine Hauptstütze bei der Bestimmung der Antitumoraktivität für Ansätze im Zusammenhang mit B-Zell-Malignomen. At Labcorp, we employ a luciferase-expressing Raji cell line (Raji-Luc) to allow us to track disease progression and therapeutic response over time through in vivo optical imaging. Raji-Luc ist ein ausgezeichnetes Modell zur Evaluierung CD19-gesteuerter CAR-T-Therapien. Wir haben dieses Modell sowohl bei SCID- als auch bei NSG-Mäusen für mehr als ein Dutzend CAR-T- oder andere Zelltherapiestudien verwendet. In vielen Fällen ist der immundefizienteste Mausstamm, NSG, für das Überleben und die Persistenz der Zelltherapie erforderlich. Daher validierten wir das Wachstum von Raji-Luc in NSG-Mäusen durch In-vivo-Biolumineszenz-Bildgebung (BLI) (Abbildungen 1A und B) und fanden eine aggressive Verbreitung der Krankheit, wie durch einen Endpunkt für eine Gesamtüberlebenszeit von etwa 20 Tagen (Morbidität/Mortalität, Abbildung 1C) illustriert wird. In Übereinstimmung mit der raschen Induktion der Krankheit zeigten die Mäuse einen progressiven Körpergewichtsverlust (Abbildung 1D) und eine letztendliche Lähmung der Hintergliedmaßen, sodass eine Euthanasie erforderlich war.
Validierung des Raji-Luc-Wachstums bei NSG-Mäusen
Anti-Tumor-Aktivität von Anti-CD20 Monoklonaler Antikörper-Rituximab
Ähnlich wie CD19 ist auch CD20 ein Marker für B-Zellen und war ein erstes Ziel von Wirkstoffen, die sich auf B-Zell-Malignome wie das Non-Hodgkin-Lymphom konzentrieren. Die klinische Entwicklung des monoklonalen Anti-CD20-Antikörpers Rituximab erwies sich als bahnbrechend für den Einsatz monoklonaler Antikörper als onkologisches Therapeutikum. In SCID-Mäusen haben wir die Anti-Tumor-Aktivität von Rituximab getestet und ein erhöhtes Gesamtüberleben (Abbildung 2A) gezeigt, das mit einer reduzierten Ganzkörper-Tumorlast korrelierte, bestimmt durch in-vivo BLI (Abbildungen 2B und 2C). Ähnlich wie bei Studien an NSG-Mäusen beobachteten wir klinische Anzeichen eines Krankheitsfortschritts wie Hintergliedmaßenlähmung und Körpergewichtsverlust (Abbildung 2D). Zusätzlich zu In-vivo-BLI untersuchten wir auch die Inzidenz der Krankheit in verschiedenen Geweben mit Ex-vivo-BLI (Tabelle 1). Durch Ex-vivo-Analysen konnten wir weiter zeigen, dass die Behandlung mit Rituximab die Krankheitslast insgesamt reduziert.
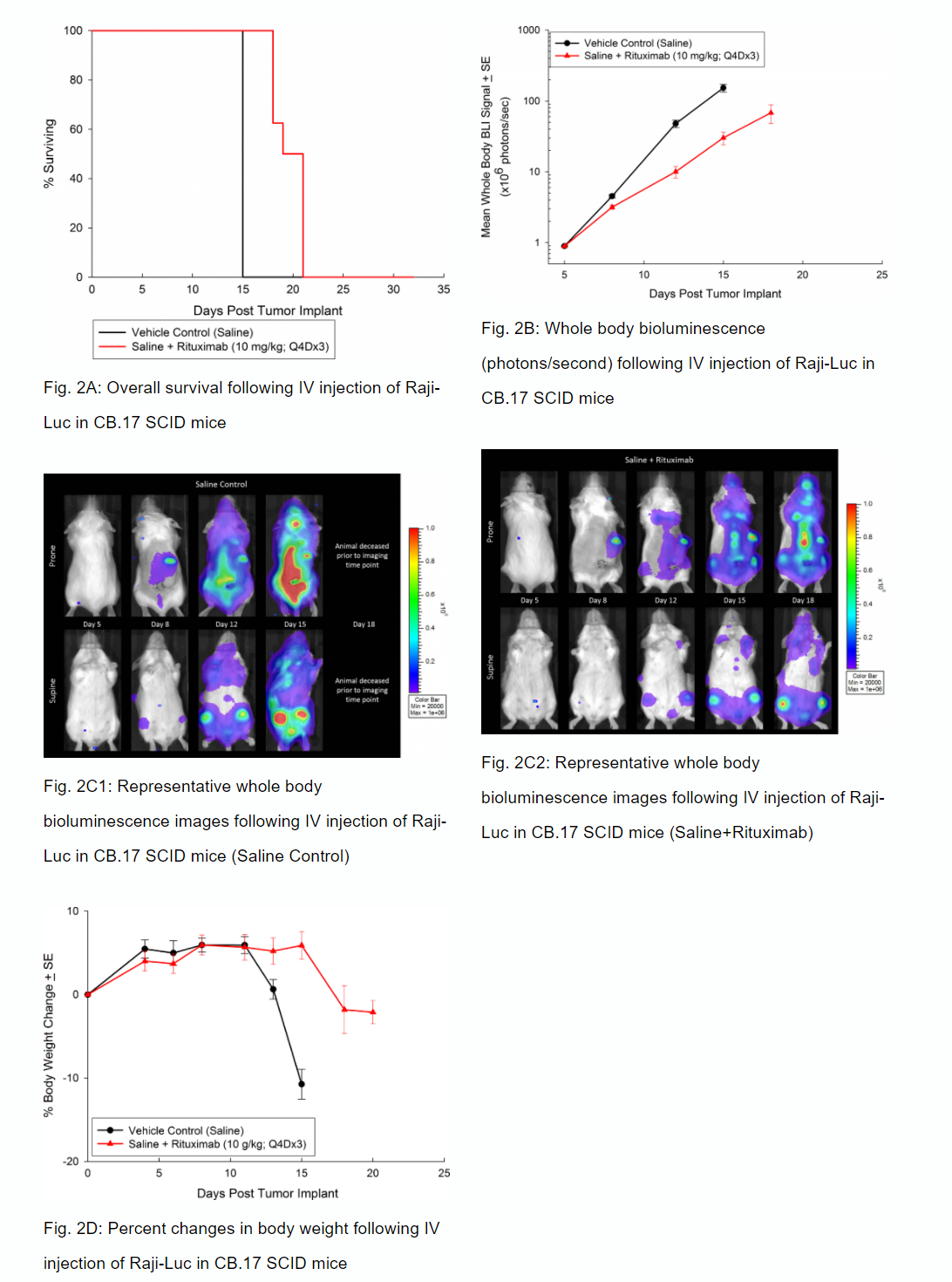
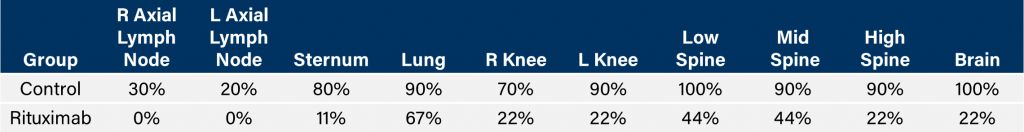
Tabelle 1: Inzidenz der disseminierten Krankheit nach IV-Injektion von Raji-Luc in CB.17-SCID-Mäuse.
Evaluierung des Raji-Luc-Modells in der SC-Situation bei SCID-Mäusen
Während die meisten therapeutischen Ansätze das Raji-Luc-Modell nach IV-Implantation verwendet haben, gab es einige Fälle, in denen Anti-Tumor-Strategien subkutan (SC) evaluiert werden mussten. Zu diesem Zweck validierten wir das Wachstum der Raji-Luc-Linie in der SC-Situation in SCID-Mäusen. Die Linie wächst recht schnell mit einer viertägigen Verdoppelungszeit und etwa 27 Tagen von der Implantation bis zur Erfüllung der Euthanasiekriterien (Abbildung 3).
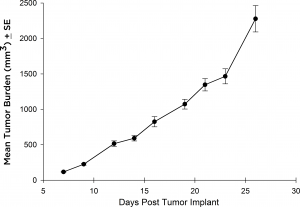
Abb. 3: Subkutanes Wachstum von SC-implantierten Raji-Luc-Zellen in CB.17-SCID-Mäuse
Somit bietet Raji-Luc sowohl im SCID- als auch im NSG-Hintergrund ein schnelles Modell, mit dem CD19- oder CD20-gerichtete Therapien getestet werden können.
Contact us to speak with one of our scientists about how Raji-Luc or one of our other models can be used for your next CAR-T study.
Verweise
Unterhalten wir uns
Kontakt