Date: November 2018
Lymphome stellen eine Reihe von Lymphoidzellmalignomen dar, die von indolent bis aggressiv reichen können. B-Zell-abgeleitete Lymphome, insbesondere das Non-Hodgkin-Lymphom (NHL), sind am häufigsten, aber diese Krankheit kann auch von T-Zellen ausgehen. 2018 werden schätzungsweise 74,68 neue Fälle von NHL in den Vereinigten Staaten diagnostiziert werden und 19,91 Patienten werden daran sterben. Während die Fünf-Jahres-Überlebensrate für NHL mit 71 % relativ hoch ist[1], sind Rezidive häufig, so dass die weitere Entdeckung verbesserter Behandlungen für Lymphome wichtig für das langfristige Überleben dieser Patienten ist.
Forscher nutzen die präklinische Mausmodellierung von Lymphomen, um neue Kombinationsstrategien aus konventioneller Chemotherapie oder Bestrahlung und immunmodulierenden Wirkstoffen zu erkunden. To support these efforts, Labcorp has developed the murine B cell lymphoma model, A20. A20 wurde von einem spontanen Retikulumzell-Sarkom einer alternden Balb/c-Maus abgeleitet.[2] Von A20 Tumoren wird berichtet, dass sie PD-L1 exprimieren[3], was mit unserem RNAseq-Profil (Daten nicht gezeigt) und mit mehreren menschlichen Lymphomsubtypen übereinstimmt[4] und es damit für die Verwendung in der immuntherapeutischen Wirkstoffentwicklung attraktiv macht.
In einem Modell-Spotlight 2017 stellten wir erste Wachstumsdaten sowie das Ansprechen auf eine Therapie vor, die kurz nach einem subkutanen Implantat eingeleitet wurde. 2018 setzten wir unsere Bemühungen fort, die Charakterisierung dieses Modells zu erweitern. Hier präsentieren wir initiale Antitumor-Ansprechdaten bei etablierten subkutanen A20-Tumoren sowie die gegenwärtige Wachstumskinetik eines systemischen Luziferase-aktivierten A20-Modells, bei dem die Tumorprogression durch Biolumineszenz-Bildgebung (BLI) überwacht wird.
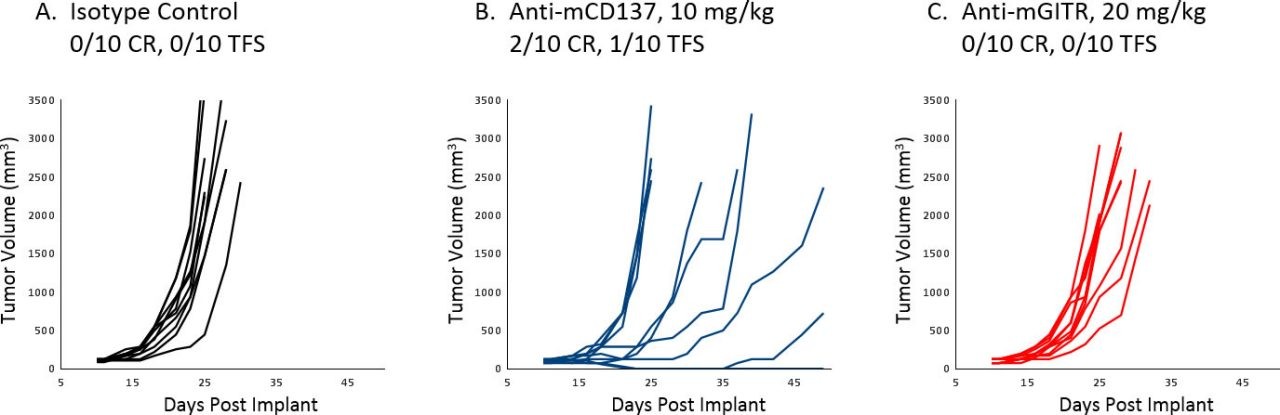
Die Behandlung von A20 mit Immuntherapeutika in-vivo ist äußerst wirksam gegen Krankheiten im Frühstadium und führte zu mehreren vollständigen Reaktionen. Erwartungsgemäß führt jedoch die Behandlungseinleitung nach der Etablierung von Tumoren zu einem viel begrenzteren Ansprechen. Abbildung 1 veranschaulicht das individuelle (A-F)-Wachstum von Kontrolltumoren und solchen, die mit anti-mPD-1 oder anti-mPD-L1 als Monotherapie oder in Kombination mit fokaler Bestrahlung durch SARRP (XStrahl) behandelt wurden. Die Kombinationstherapie führte zu einer besseren als additiven Anti-Tumor-Reaktion, was darauf hindeutet, dass diese Strategien im A20-Modell leicht bewertet werden können, sobald die Tumore etabliert sind. Darüber hinaus war die Wirksamkeit von anti-mGITR und anti-mCD137 gegen etablierte A20-Tumoren minimal bis mäßig, was einen breiten dynamischen Bereich zur Beurteilung der Verbesserung in der Kombination dieser Antikörper und Prüfpräparaten ermöglichte (Abbildung 2 A-C).
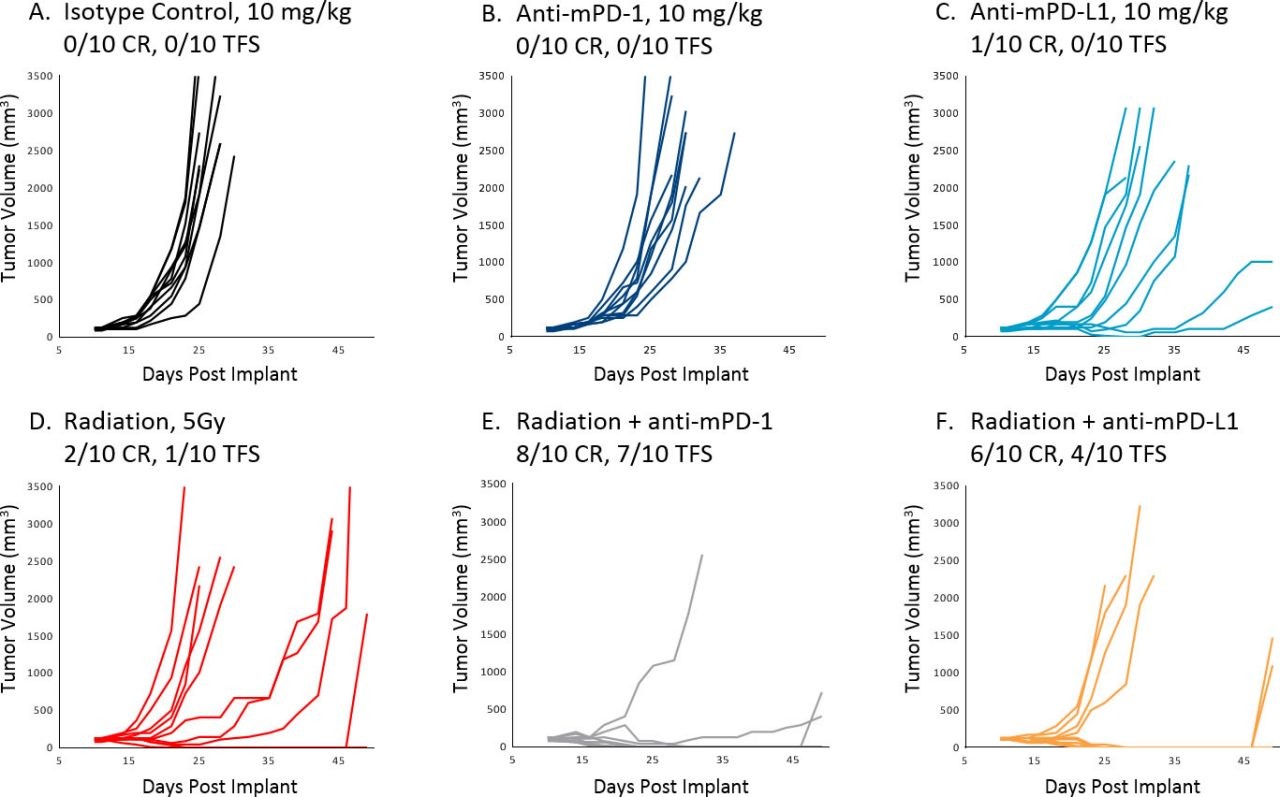
Abb. 1: Antwort etablierter A20-Tumore auf Behandlung; CR=Vollständige Remission, TFS=Tumorfreies Überleben
Um den Nutzen des A20-Lymphommodells weiter zu erhöhen, haben wir die A20-Zelllinie luciferase-aktiviert, womit sie zur Überwachung der Tumorprogression bei systemischen Erkrankungen eingesetzt werden kann. Die mediane Verdopplungszeit des Modells beträgt 2,7 Tage mit einem therapeutischen Fenster von etwa drei Wochen.
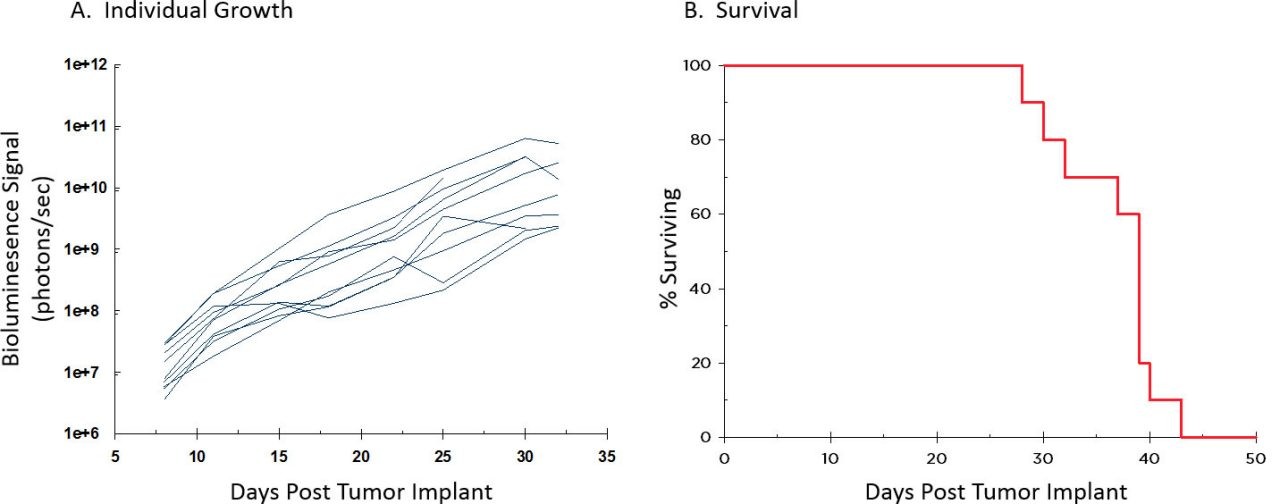
Abb. 3: Individuelle A20-Luc-Wachstumskinetik und Überleben
Abbildung 3 zeigt die individuelle Tumorprogression, die durch BLI (A) und das Gesamtüberleben (B) bestimmt wird, was auf eine günstige Wachstumskinetik hinweist, und Abbildung 4 zeigt eine repräsentative BLI-Bildgebung im Zeitverlauf. Bei der Nekropsie wurde eine 100-prozentige Inzidenz von Leberläsionen und 70-prozentige Inzidenz von Lähmungen der Hintergliedmaßen und/oder Läsionen an anderen Organen (d. h. Milz, Eierstock, Bauchspeicheldrüse) festgestellt. Abdominale Dehnung war ein häufiges klinisches Zeichen, das sich zwischen den Tagen 30–32 manifestierte und gut mit dem Zeitpunkt eines starken BLI-Signals in den Abbildungen 3 und 4 korreliert. Eine Folgestudie zur Untersuchung der Reaktion auf Checkpoint-Blockade und kostimulatorische Moleküle wird derzeit mit diesem systemischen Modell durchgeführt.
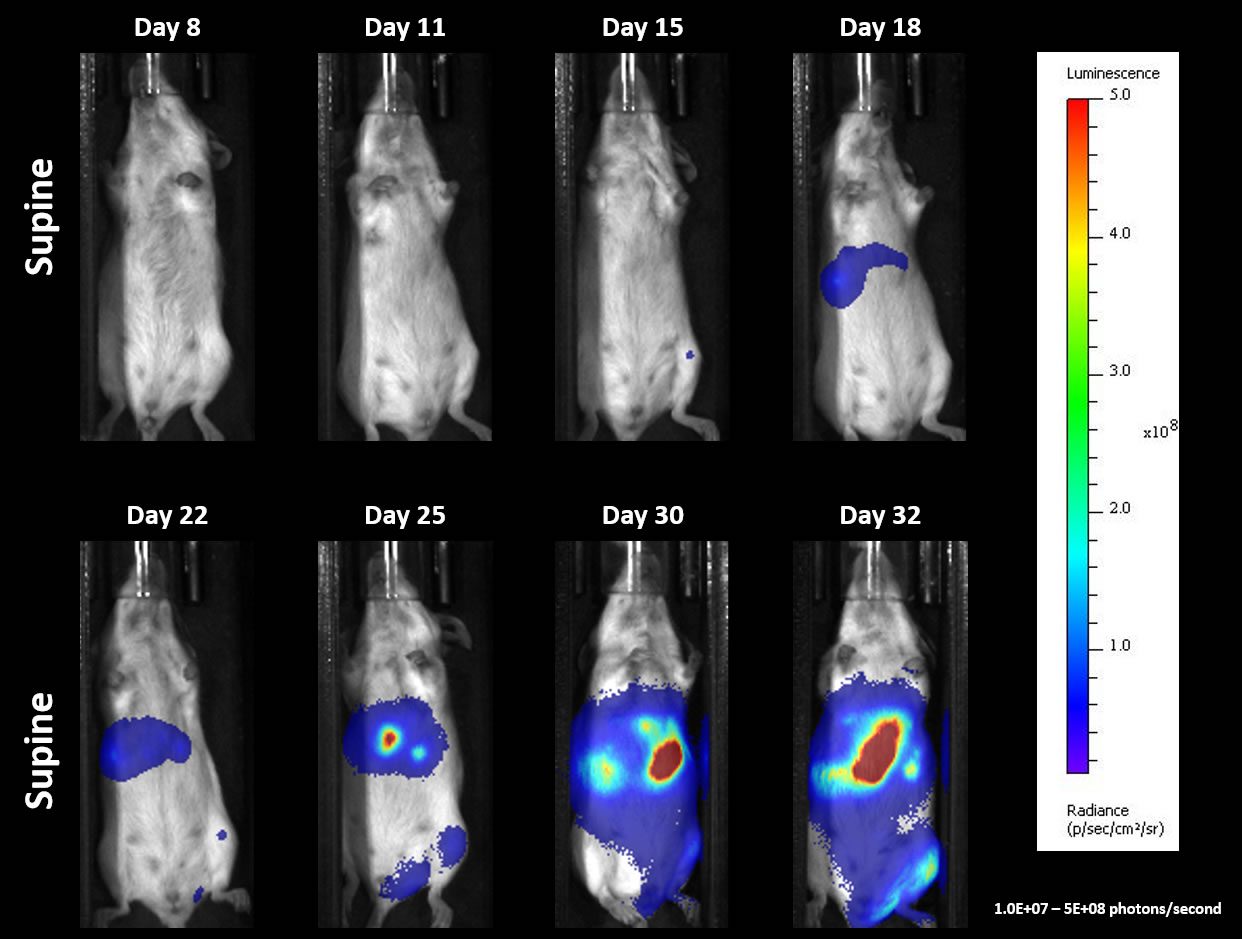
Abb. 4: Systemische A20-Luc – Repräsentative BLI-Bilder im Zeitverlauf
Das A20-Modell bietet robuste präklinische Mittel zur Untersuchung von B-Zell-Lymphomen sowohl mit subkutanen als auch mit systemischen Methoden.
Please contact Labcorp to speak with our scientists about how A20 or one of our other syngeneic models can be used for your next immuno-oncology study.
Verweise
[2] Kim KJ, Kanellopoulos Langevin C, Merwin RM, Sachs DH, Asofsky R (1979) Etablierung und Charakterisierung von BALB/c-Lymphomlinien mit B-Zell-Eigenschaften. Journal of Immunology, 122(2): 549–554.
[3] Sagiv-Barfi I, Kohrt HEK, Czerwinski DK, Ng PP, Chang BY, Levy L (2015) Die therapeutische Antitumorimmunität durch Checkpoint-Blockade wird durch Ibrutinib verstärkt, einem Hemmstof von sowohl BTK als auch ITK. PNAS, 112(9): E966-E972.
Unterhalten wir uns
Kontakt