Date: July 2017
Das duktale Adenokarzinom des Pankreas (PDAC) ist die häufigste Form von Bauchspeicheldrüsenkrebs und macht etwa 95 % aller Fälle aus. Im Jahr 2017 werden in den USA ungefähr 50.987 Menschen mit PDAC diagnostiziert werden und ungefähr 40.936 Patienten werden sterben, was PDAC zu einer der tödlichsten Krebsarten macht. In den USA ist eine Kombinationschemotherapie auf der Basis von Metaboliten und anti-mitotischem Taxan der Behandlungsstandard, aber diese Behandlungsoptionen verbessern das Gesamtüberleben historisch gesehen nur um Wochen. Es besteht ein dringender und unerfüllter medizinischer Bedarf an neuartigen therapeutischen Ansätzen zur Behandlung von Bauchspeicheldrüsenkrebs.
Da so viele neuartige Ansätze zur Behandlung von Bauchspeicheldrüsenkrebs zu enttäuschenden klinischen Ergebnissen geführt haben, haben sich viele Wissenschaftler im Bereich der Wirkstoffentwicklung der Immuntherapie bei Bauchspeicheldrüsenkrebs zugewandt, basierend auf den jüngsten Erfolgen in Bezug auf die Nutzung des Immunsystems zur Behandlung anderer Krebsarten. Although there are a limited number of syngeneic mouse pancreatic cancer cell lines, Labcorp has characterized the Pan02 PDAC model for immuno-oncology applications. Pan02 wurde von C57BL/6-Mäusen abgeleitet, denen orthotopisches 3-Methylcholanthren verabreicht wurde, und ist gegenüber vielen Standardchemotherapeutika unempfindlich.1Pan02 enthält eine Mutation im SMAD4-Gen, die zu Funktionsverlust führt und funktionell den inaktivierenden Mutationen bei ungefähr 30 % der menschlichen Bauchspeicheldrüsenkrebserkrankungen ähnlich ist.2
Mittlere und individuelle Wachstumskurven
Labcorp maintains Pan02 as a transplantable fragment model, and its mean growth kinetics (Figure 1A) and individual animal growth curves (Figure 1B) are illustrated. Pan02 hat eine mittlere Tumorverdopplungszeit von sechs Tagen, die langsamer ist als die der meisten syngenen Tumoren der Mauszelllinie. Dieses langsamere Wachstum kann es für die Immuntherapie praktikabler machen, da Therapeutika Zeit haben, das Immunsystem zu modifizieren und eine Antitumoraktivität hervorzurufen, bevor Tumoren die Euthanasiekriterien erreichen.
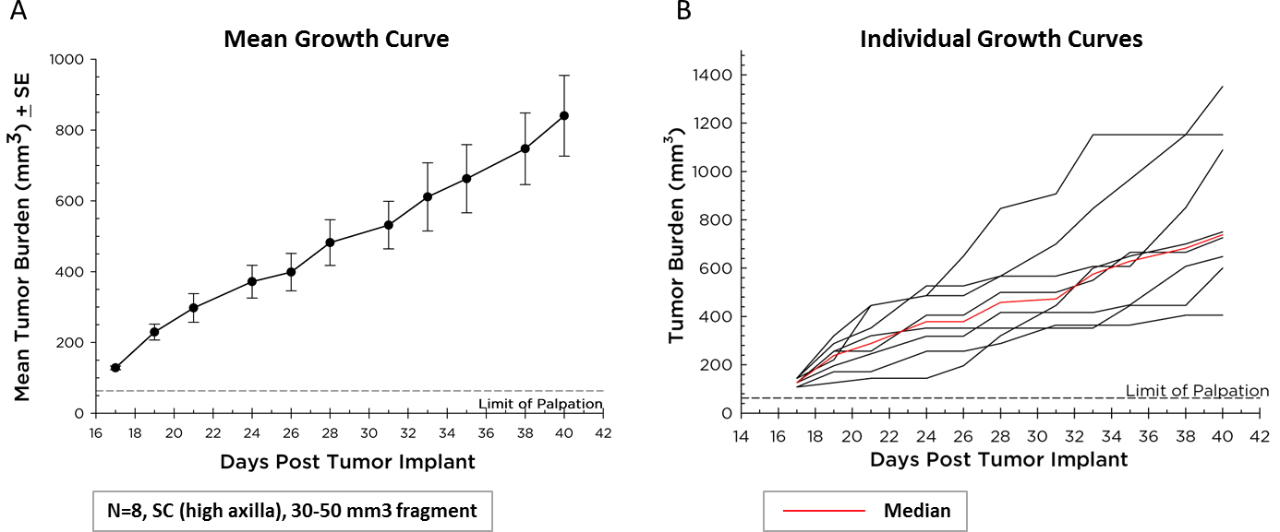
Abb. 1 (A&B) – Pan02-Pankreaskrebswachstum in C57BL/6-Mäusen
Wirksamkeit und Überlebensraten von Anti-PD-1 und Anti-CTLA-4
Derzeit sind T-Zell-Checkpoint-Inhibitor-Antikörper gegen CTLA-4, PD-1 und PD-L1 zur Behandlung von Krebs außer Bauchspeicheldrüsenkrebs zugelassen. Wir haben Anti-CTLA-4 (Klon 4F10) und Anti-PD-1 (Klon RMP1-14), individuell und in Kombination, im Pan02-Modell getestet. Die Dosierung wurde drei Tage nach der Implantation begonnen und die mittlere Tumorbelastung der Gruppe zeigt in keiner Gruppe eine signifikante Aktivität (Abbildung 2A). Es ist häufig der Fall, dass Immuntherapien nur bei einer Untergruppe von behandelten Tieren Aktivität zeigen, sodass einzelne Tierparzellen wertvoll sind, um diese Reaktionen zu erkennen. Die einzelnen Tierparzellen zeigen jedoch keine signifikante Aktivität durch die Testmittel, die nicht auch in der Kontrollgruppe beobachtet werden kann (Abbildung 2B). Wie aufgrund der Wachstumsreaktionsdaten erwartet, gibt es auch keine Verbesserung der Überlebenschance in den behandelten Gruppen im Vergleich zur Kontrollgruppe (Abbildung 3).
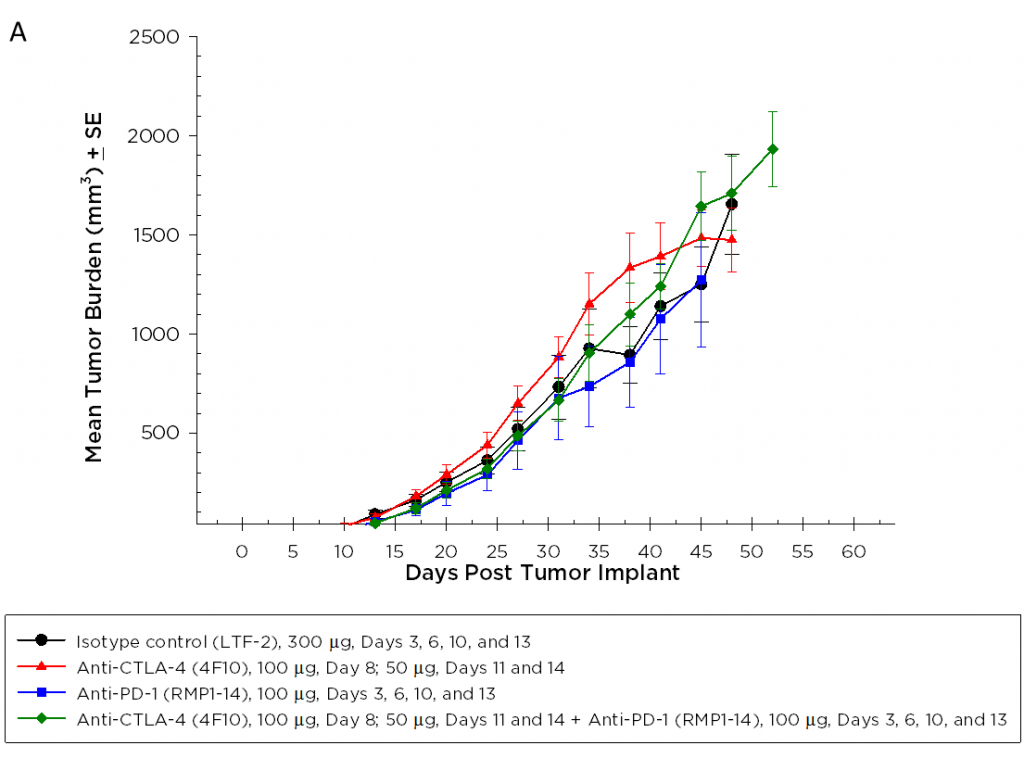
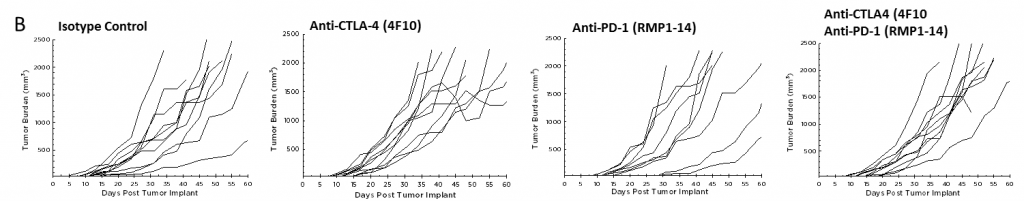
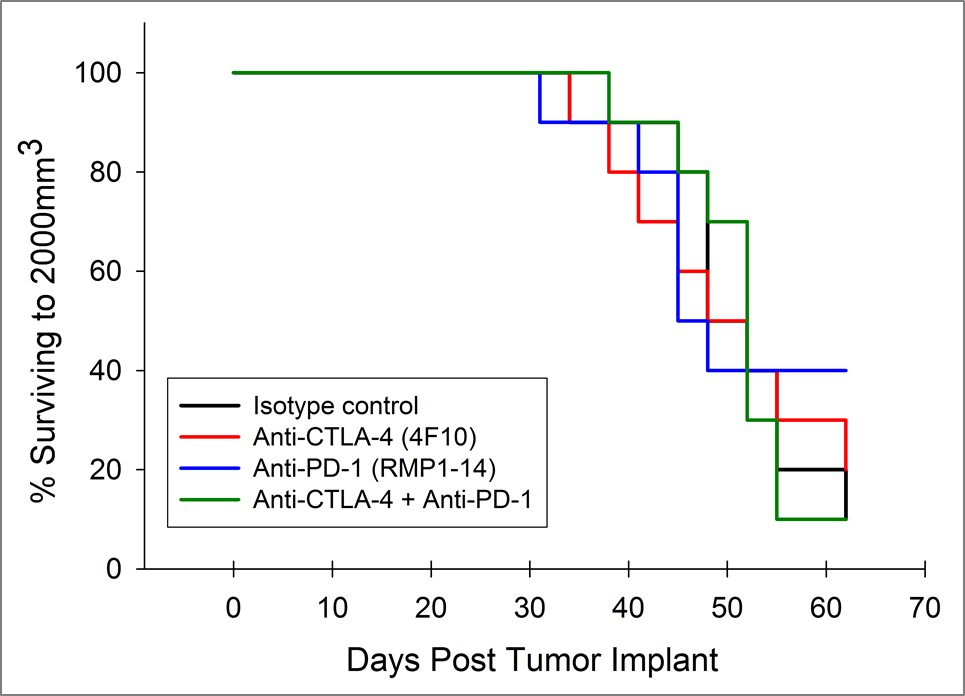
Abb. 3: Überleben von Mäusen mit Pan-02-Pankreastumoren, die mit Anti-PD-1 und Anti-CTLA-4 behandelt wurden
Immunprofilerstellung
Wir wollten herausfinden, ob die Checkpoint-Inhibitoren einen Einfluss auf die Immunzelleninfiltration in den Pan02-Tumoren haben. Abbildung 4 zeigt die Immunprofile für die Gesamt-CD45+-Leukozyten, CD4+-T-Zellen, CD8+-T-Zellen, die regulatorischen T-Zellen (Tregs), die monozytischen myeloischen Suppressorzellen (M-MDSC) und die granulozytischen myeloischen Suppressorzellen (G-MDSC).
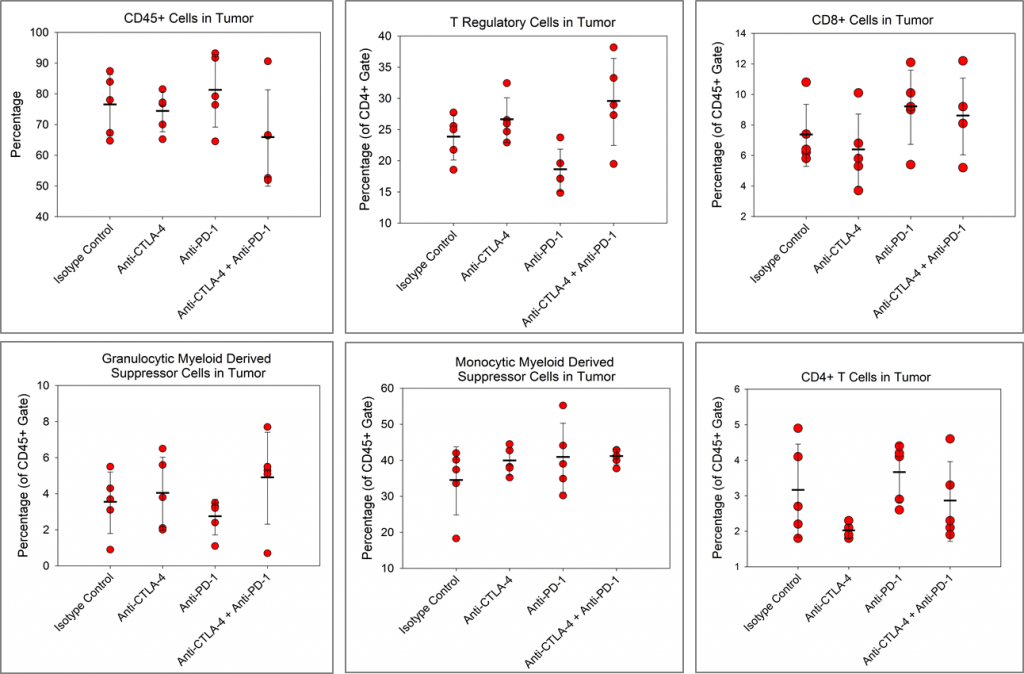
Obwohl es einen Trend zu reduzierten CD4+-T-Zellen in der mit Anti-CTLA-4 behandelten Gruppe und einen Trend zu reduzierten regulatorischen T-Zellen in der mit Anti-PD-1 behandelte Gruppe relativ zur Isotypkontrollgruppe gibt, wurden keine anderen Immunveränderungen beobachtet. Obwohl Checkpoint-Inhibitoren alleine keine offensichtliche Aktivität im Pan02-Modell zeigen, gibt es veröffentlichte Berichte über die Checkpoint-Inhibitoren-Aktivität in Pan02-Tumoren durch Bestrahlung 3 oder einen kostimulatorischen Agonisten gegen CD40-Antikörper.4 Wichtig ist, dass Anti-PD-L1 in diesen Studien sowohl mit Anti-CD40 als auch mit Strahlung stark synergisiert ist, was darauf hinweist, dass Checkpoint-Hemmung trotz der Unempfindlichkeit von Pan02-Tumoren gegenüber Einzelwirkstoff-Checkpoint-Inhibitoren die Aktivität von Kombinationspartnern fördern kann.
Contact us to speak with one of our scientists to see how Pan02 or one of our other syngeneic models can be used for your next immuno-oncology study.
Verweise
2Wang Y et al., Genomic Sequencing of Key Genes in Mouse Pancreatic Cancer Cells. 2012. Curr Mol Med. Vol. 12(3): 331–341.
3Azad A et al., PD-L1 blockade enhances response of pancreatic ductal adenocarcinoma to radiotherapy. 2017. EMBO Mol Med. Vol 9: 167–180.
Unterhalten wir uns
Kontakt