Date: October 2020
With the development of increasingly complex Immuntherapien, biotech/pharma companies are now looking for more relevant and accurate preclinical tumor models to predict precise drug responses.
Während präklinische Onkologiestudien darauf abzielen, menschliche Krankheiten im Tierversuch nachzuahmen, besteht die größte Herausforderung für die Forscher in der Übersetzbarkeit der Ergebnisse. Ein ideales präklinisches Tumormodell würde nicht nur den spezifischen Krebs-Subtyp verwenden, sondern auch die komplexe Tumor-Mikroumgebung simulieren, die für die Tumorentstehung erforderlich ist.
Mehrere neuere Publikationen haben gezeigt, dass der Ort des Tumorimplantats kritische Parameter wie Tumorkinetik, Vaskularisierung, Architektur, hypoxische Umgebung und Empfindlichkeit gegenüber antitumoralen Behandlungen beeinflussen kann1-4.
Die häufiger verwendeten subkutanen (SC) Modelle haben den Vorteil, dass die Tumormessungen mit dem Messschieber erfolgen können. Sie unterscheiden sich jedoch von den viszeralen Tumoren in der Morphologie, der Gefäßdichte, den Immunzellinfiltraten und der Tumor-Mikroumgebung. Genau dies versucht ein orthotopisches (OT) Tumormodell zu erfassen, d. h. die Implantation von Tumorzelllinien oder vom Patienten gewonnenen Xenografts in das zum Gewebetyp passende Organ.
Im spezifischen Kontext der Immuntherapie haben publizierte Daten gezeigt, dass OT-Tumormodelle immunsuppressiv sind mit einer größeren Anzahl von Makrophagen und weniger empfindlich auf bestimmte Arten der Immuntherapie reagieren können als das gleiche Modell, das subkutan implantiert wird2.
Um das Potenzial von OT-Modellen zu erforschen, eine relevantere Tumor-Mikroumgebung zu schaffen und gleichzeitig als primärer Ort des Tumors im Vergleich zu ihren SC-Gegenstücken zu fungieren, haben wir einige syngene Zelllinien mit Luciferase ausgestattet, um die nicht-invasive Überwachung der Tumorprogression und Metastasierung zu ermöglichen.
Hier, in diesem Modell-Spotlight, stellen wir die Modellentwicklung von Pan02-Luc vor, der murinen Pankreas-Adenokarzinom-Zelllinie. Hinweis: Alle Arbeiten mit Tieren wurden vom Institutional Animal Care and Use Committee des Standorts genehmigt und in Übereinstimmung mit dem Handbuch für die Pflege und Nutzung von Labortieren im Rahmen eines AAALAC-akkreditierten Programms durchgeführt. Humane Euthanasiekriterien wurden auf der Grundlage des Körpergewichts und definierter klinischer Beobachtungen festgelegt.
Modellentwicklung von Pan02-Luc: Die murine Pankreas-Adenokarzinom-Zelllinie
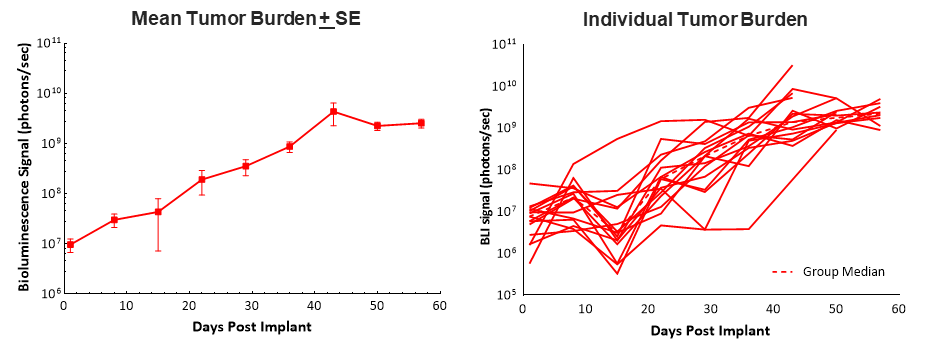
Die chirurgische Implantation von Pan02-Luc-Zellen in den Pankreaskopf bei C57BL/6-Mäusen führt zu ~100 % Tumoraufnahme und stetigem Tumorwachstum mit einer medianen Verdopplungszeit von ~6 Tagen, wie durch Biolumineszenz-Bildgebung (BLI) bestimmt wurde. Die Tiere hatten eine relativ lange mediane Überlebenszeit (Morbidität/Mortalität) von 58 Tagen, was in diesem Modell 5 bis 6 Wochen der Wirkstoffabgabe und Wirksamkeitsbewertung erlaubt (Abb. 1). Das Anwachsen des Tumors und seine Progression hatten keine nachteiligen Auswirkungen auf das Körpergewicht, und die häufigste klinische Beobachtung, die zu Euthanasie führte, war die abdominale Auftreibung (Daten nicht gezeigt).
Es ist bekannt, dass Bauchspeicheldrüsenkrebs als „kalter“ Tumor gilt und nicht gut auf Immuntherapien anspricht. Daher haben wir den Checkpoint-Inhibitor anti-mPD-1 allein und in Kombination mit Gemcitabin getestet.
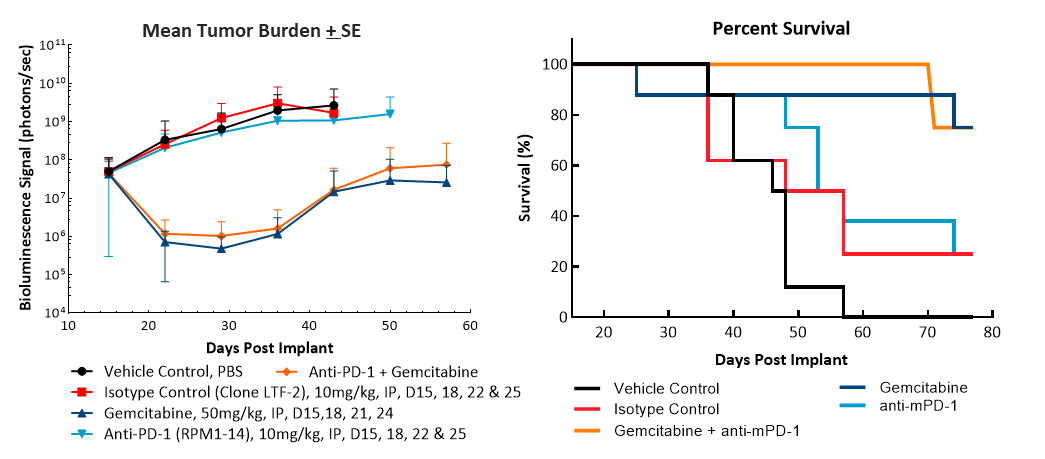
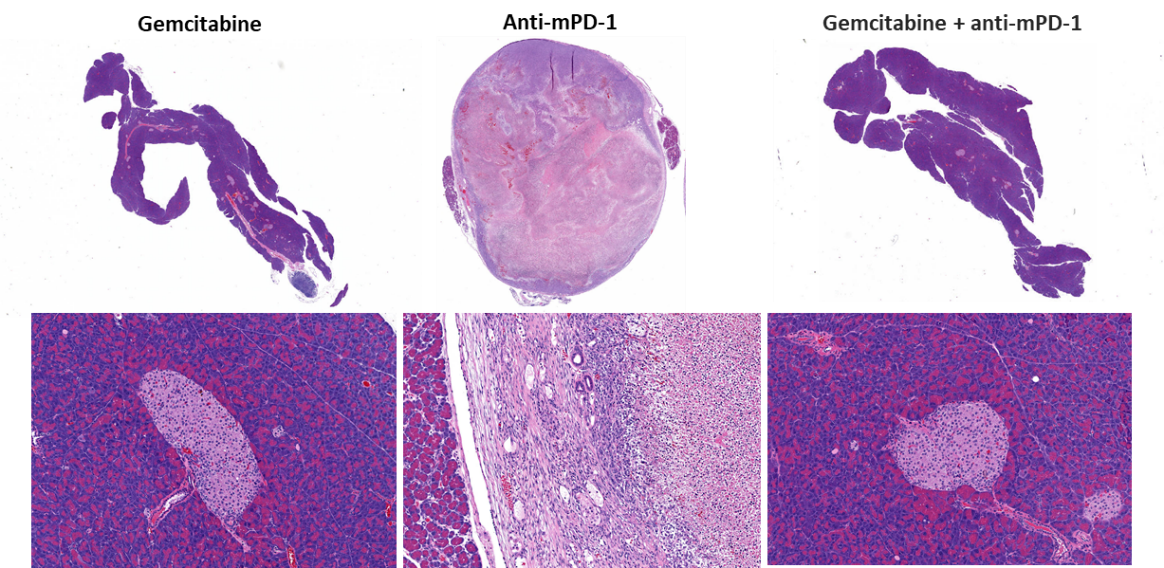
Wirksamkeitsevaluierung nach Behandlung mit anti-mPD-1 (10 mg/kg) zeigte keine aussagekräftige Antwort (Abb. 2). Die Behandlung mit dem klinisch relevanten Standard-Chemotherapeutikum Gemcitabin (50 mg/kg) führte zu einer vollständigen Tumorrückbildung (CR) bei 87 % (7/8) der Tiere und 62 % (5/8) wurden nach BLI als tumorfreie Überlebende (TFS) eingestuft. Bei zwei Tieren wurde nach Beendigung der Behandlung ein Nachwachsen beobachtet. Die Kombination von Gemcitabin mit anti-mPD-1 führte zu keinen zusätzlichen TFS gegenüber dem Einzelwirkstoff Gemcitabin. Repräsentative Biolumineszenz-Bilder (Abb. 2C) und Histologie-Bilder (Abb. 2D) von Tumoren, die am Ende der Studie aufgenommen wurden, bestätigen die Tumorrückbildung in den mit Gemcitabin behandelten Gruppen.
Abb. 2. Pan02-Luc-Ansprechen auf anti-mPD-1- und Gemcitabin-Behandlungen

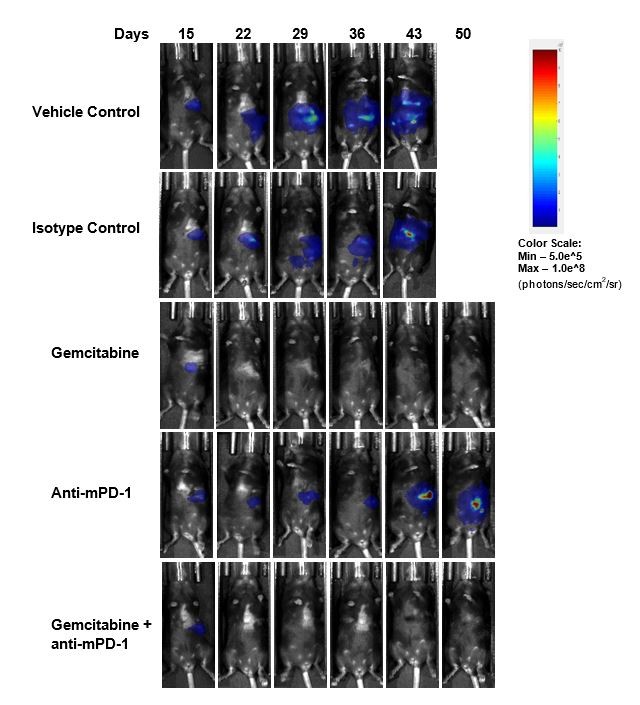
Wir haben bereits früher über die Reaktion des subkutanen Pan02-Modells auf Immuntherapie berichtet (siehe dieses frühere Modell-Spotlight). So fanden wir in einem Vergleich mit den hier gezeigten OT-Daten mit der Luc-aktivierten Pan02-Zelllinie, dass die Reaktion auf anti-mPD-1 im OT-Modell ähnlich wie im SC elterlichen Pan02-Modell war. Das Ansprechen auf Gemcitabin war bei gleicher Dosiskonzentration im OT-Modell signifikant höher als im SC-Modell, wo die Tiere eine Verzögerung des Tumorwachstums und 80 % PR (partielle Regression), 20 % CR und keine TFS aufwiesen (Tabelle 1).
Tabelle 1. Vergleich von SC und OT Pan02 Tumoransprechverhalten auf Gemcitabin-Behandlung
Die Immunzellinfiltration in die OT-Tumoren wurde mittels Durchflusszytometrie evaluiert, die die schlechten lymphatischen Zellinfiltrationen bestätigte, die für ein nicht-immunogenes oder „kaltes“ Tumormodell charakteristisch sind (Abb. 3A-B). Während CD8+ und CD4+ T-Helferzellen nur je 1,6 % bzw. 1 % der CD45+-Population ausmachen, waren die immunsuppressiven myeloischen Zellpopulationen in großer Menge vorhanden, wobei monozytär-myeloisch-abgeleitete Suppressorzellen (M-MDSC) und M1- und M2-tumorassoziierte Makrophagen (TAM) die dominanten Zellsubpopulationen waren. Der Vergleich der Immunprofile des OT- und des SC-Modells zeigte, dass regulatorische T-Zellen (Tregs), Natürliche Killerzellen (NK) und Natürliche Killer-T-Zellen (NKT) bei OT-Tumoren signifikant reduziert waren. Die myeloische Population war im Allgemeinen bei OT-Tumoren größer, welche bis zu 82 % der CD45+-Zellen ausmachten, während sie im SC-Modell 68 % betrug. Granulozytär-MDSC und M2-TAM waren bei den OT-Tumoren signifikant höher, während die dendritischen Zellen niedriger waren und auf einen eher entzündungshemmenden immunsuppressiven Phänotyp hindeuteten.
Abb. 3. Durchflusszytometrische Analyse von SC- und OT-Tumoren
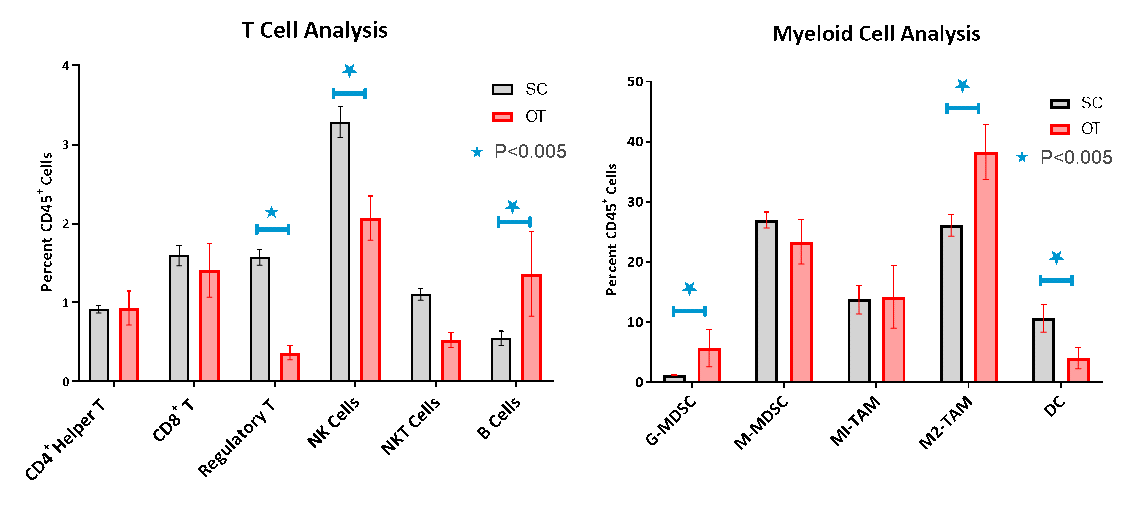
In unseren Händen könnten diese subtilen Unterschiede zwischen dem SC- und dem OT-Modell einen Einblick in die Reaktionsintensität der von uns untersuchten Behandlungen geben. Es wurde berichtet, dass diese Unterschiede klinisch kritisch sind, da sie die Vorhersagbarkeit des Ansprechens und der Prognose bei Patienten mit Bauchspeicheldrüsenkrebs beeinflussen5-7.
Die orthotopische Tumorimplantation bietet eine Modellierung des Krebsfortschritts und des Ansprechens auf Wirkstoffe in einer Weise, die klinische Szenarien besser simuliert. Da jedes Organ und seine Mikroumgebung einzigartig ist und nicht durch subkutane Implantation repliziert werden kann, ist es wichtig, das orthotopische Modell zu verwenden, wenn es verfügbar ist.
At preclinical oncology, we offer several luciferase-enabled models for this purpose.
Bitte nehmen Sie Kontakt zu uns auf, wenn Sie daran interessiert sind, dieses Modell weiter zu besprechen.
Verweise
1. Erstad DJ, et al., 2018. Orthotopic and heterotopic murine models of pancreatic cancer and their different responses to FOLFIRINOX chemotherapy. Dis Model Mech., Jul 1; 11(7): dmm034793
2. Devaud C, et al., 2014. Tissues in different anatomical sites can sculpt and vary the tumor microenvironment to affect responses to therapy. Mol Ther., Jan 22(1):18-27
3. Guerin MV, Finisguerra V, Van den Eynde BJ, Bercovici N and Trautmann A, 2020. Preclinical murine tumor models: a structural and functional perspective. eLife., 2020;9:e50740
4. Qui W and Su GH. 2013. Development of orthotopic pancreatic tumor mouse models. Methods Mol Biol., 980:215-223
5. Kurahara H, et al., 2011. Significance of M2-polarized tumor-associated macrophage in pancreatic cancer. J Surg Res., May 15; 167(2):e211-e219
6. Parente P, et al., 2018. Crosstalk between the tumor microenvironment and immune system in pancreatic ductal adenocarcinoma: Potential targets for new therapeutic approaches. Gastroenterology Res and Practice. 2018:7530619
7. Lankadasari M, et al., 2019. TAMing pancreatic cancer: combat with a double-edged sword. Mol Cancer 18:48
Unterhalten wir uns
Kontakt