Autor: Sumithra Urs, PhD | Wissenschaftlerin, Wissenschaftliche Entwicklung
Date: June 2019
Bauchspeicheldrüsenkrebs ist der neunthäufigste diagnostizierte Krebs und zählt zu den tödlichsten mit der niedrigsten 5-Jahres-Überlebensrate von 5 bis 8 %. [1,2,3] Allein in diesem Jahr schätzt die American Cancer Society, dass 56.770 Menschen mit der Krankheit diagnostiziert werden, von denen mehr als 45.750 möglicherweise nicht überleben werden. Pancreatic ductal adenocarcinoma (PDAC) being the most prevalent and aggressive form of exocrine pancreatic cancer accounts for ~90 % of cases with mortality equaling incidence.[4,5]
Bei der Diagnose hat eine große Mehrheit der PDAC-Patienten entweder eine lokal fortgeschrittene, nicht resezierbare oder metastatische Erkrankung. Die stille Ausbreitung der Krankheit und das Auftreten krankheitsspezifischer Symptome nur in fortgeschrittenen Stadien machen die Früherkennung sehr schwierig und tragen zu der niedrigen Überlebensrate bei. Zu den Behandlungsoptionen für resektable Patienten gehören Operationen, gefolgt von einer systemischen Erstlinien-Chemotherapie (Gemcitabin, FOLFIRINOX, Paclitaxel) oder einer kombinierten Radiochemotherapie. Für lokal fortgeschrittene, nicht resezierbare Patienten umfasst das Regime eine Multiwirkstoff-Chemotherapie (5-FU, Oxaliplatin, Irinotecan) oder eine Radiochemotherapie.[6] Da diese Behandlungen Patienten mit Bauchspeicheldrüsenkrebs nur begrenzte Vorteile bieten, werden derzeit neuere Optionen wie Immuntherapeutika in klinischen Studien getestet.
PDAC sind gekennzeichnet durch das Vorhandensein eines fibrotischen Stromas, eine geringe Mutationsbelastung, den Mangel eine CD8+-T-Zellen-Infiltration und das Vorhandensein von immunsuppressiven myeloischen Zellpopulationen, die alle zu den typischen nicht-immunogene Tumoreigenschaften beitragen.[7] Aktuelle Ansätze zur Verbesserung des Ansprechens an die Behandlung konzentrieren sich auf die Erhöhung des Transports von T-Zellen zu den Tumoren unter Verwendung von Mitteln wie Strahlentherapie (RT). RT allein hat bei den meisten soliden Tumoren das Potenzial, das Immunsystem zu aktivieren, um nach dem zytotoxischen Tod und der Freisetzung immunstimulierender Signale eine Antitumor-Immunantwort auszulösen. Bei PDAC-Patienten bleibt das Ergebnis einer hochdosierten RT allein oder in Kombination mit Chemotherapeutika im Allgemeinen unbefriedigend[8] und klinische Studien mit Einzelwirkstoffen zeigen ein schlechtes Ansprechen mit niedrigen Raten von 1 bis 2 %.[9] Mindestens 21 offene klinische Studien untersuchen derzeit die Kombination von RT mit anderen immunstimulierenden Wirkstoffen, die eine vielversprechende Option für die PDAC-Behandlung sein könnten und weitere Forschung rechtfertigen.[10] In diesem Sinne evaluieren wir auf der präklinischen Plattform Einzel- und Kombinationstherapien unter Verwendung des murinen Pan02-PDAC-Modells. Pan02 ist ein etabliertes Adenokarzinom-Modell der Stufe III, das durch chemische Induktion mit 3-MCA (3- Methylcholanthren) in männlichem C57BL/6-Mäusen entwickelt wurde.[11] In diesem Modell-Spotlight präsentieren wir In-vivo-Daten zur Wachstumskinetik des Pan02-Tumor-Modells und die Reaktion auf immunmodulatorische Antikörper, fokale Strahlung und die Kombination von RT mit immunmodulierenden Mitteln, die im syngenen C57BL/6-Mausstamm getestet wurden.
Pan 02 Wachstumsparameter
Die subkutane Implantation von Pan02 führt zur erfolgreichen Etablierung von Tumoren mit einer mittleren Verdopplungszeit von 4 bis 5 Tagen, und die Mäuse bleiben für ca. 30 Tage nach der Implantation ohne Gewichtsverlust in der Studie (Abb. 1) (Daten nicht gezeigt). Die Wachstumskinetik ermöglicht ein therapeutisches Fenster von über drei Wochen, um die Antitumor-Reaktionen in diesem Modell zu bewerten.

Die durchflusszytometrische Immunphänotypisierungsanalyse von Pan02-Tumoren bestätigte die schlechte Infiltration der Tumore mit lymphoiden Zellen (Abb. 2). While CD8+ and CD4+ helper T cells constituted only 1,6 % and 1 % of the CD45+ population, respectively, the immunosuppressive myeloid cell populations were present in abundance. M-MDSC und M1- und M2-TAM waren die dominanten Zell-Subpopulationen. Dieses Tumorimmunprofil ist charakteristisch für ein nicht immunogenes oder „kaltes“ Tumormodell, ähnlich wie es bei PDAC-Patienten beobachtet wird.

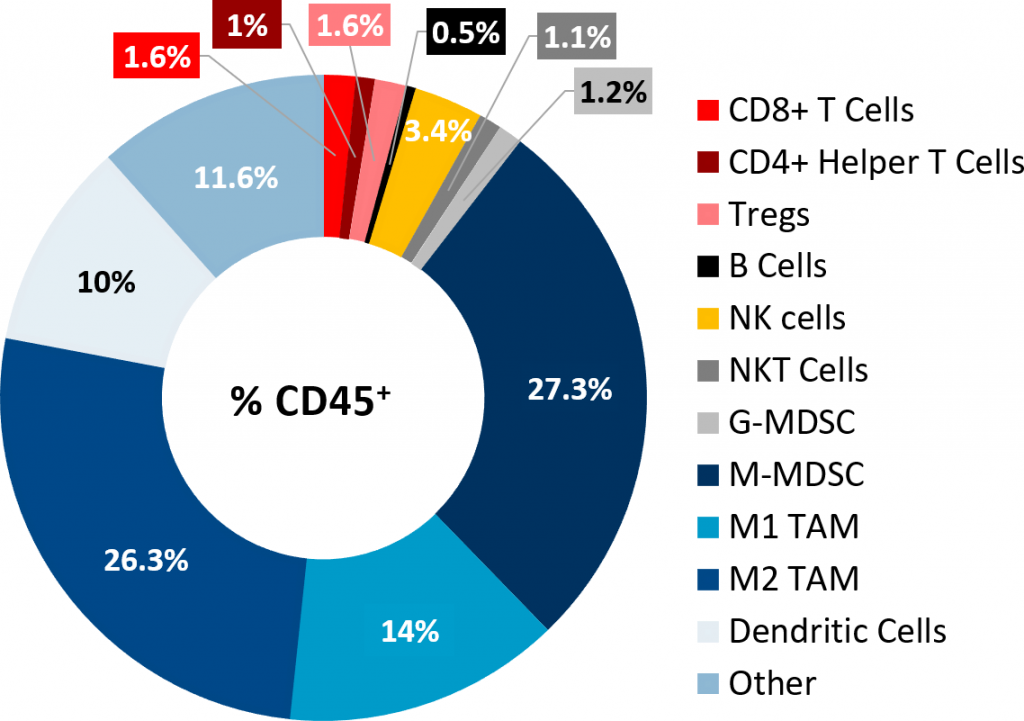
Abb. 2: Tumorimmunprofil subkutaner Pan02-Tumore.
Pan02-Reaktion auf Behandlungen mit Einzelwirkstoff
Einzelwirkstoffbehandlung von Mäusen mit Pan02-Tumor mit Gemcitabin (100 mg/kg, Q3Dx4), einer der am häufigsten verwendeten Chemotherapien bei Patienten mit Bauchspeicheldrüsenkrebs, war gut verträglich und führte zu einer statistisch signifikanten Verzögerung des Tumorwachstums (Abb. 3).

Abb. 3: Pan02-Reaktion auf Gemcitabin.
Angesichts der klinischen Untersuchung von Immuntherapien bei PDAC war unser Ziel, die Reaktionsfähigkeit unseres Pan02-Modells auf eine Vielzahl von immunmodulierenden Antikörpern zu bewerten (Abb. 4). In Übereinstimmung mit dem immunsuppressiven Profil der Pan02-Tumore war es nicht überraschend, dass dieses Modell nur minimal/gar nicht auf die Checkpoint-Inhibitoren Anti-mPD-1, Anti-mPD-L1 und Anti-mCTLA-4 und die kostimulatorischen Antikörper Anti-mCD137 und Anti-mOX40 reagierte. Alle Antikörper wurden zweimal wöchentlich mit 10 mg/kg für insgesamt 4 Dosen gegeben (Abb. 4).

Abb. 4: Pan02-Reaktion auf immunmodulierende Antikörper
Pan02-Reaktion auf Strahlung und Kombinationsbehandlungen
PADC-Patienten werden häufig mit Strahlentherapie behandelt. In unserem Mausmodell verwendeten wir die Small Animal Radiation Research Platform (SARRP; Xstrahl), um eine einzelne Dosis fokaler Strahlung (5 Gy oder 10 Gy) direkt an den Tumor abzugeben, und beobachteten eine von der Dosis abhängige Tumorwachstumsverzögerung von 9,5 und 22 Tagen im Vergleich zum unbehandelten Kontrollmodell (Abb. 5).
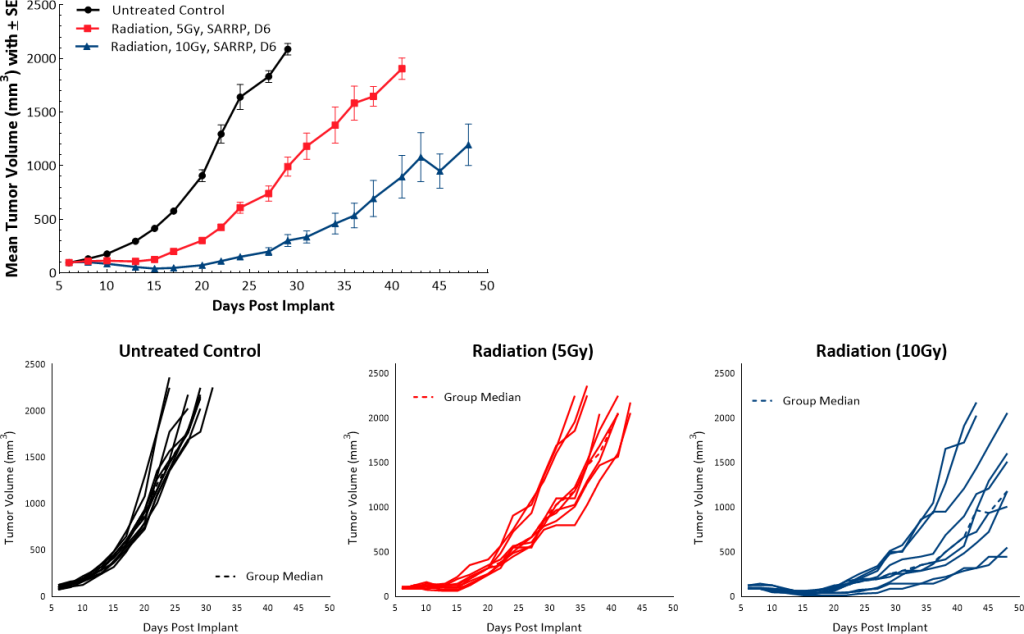
Abb. 5: Pan02-Reaktion auf fokale Strahlung.
Um die Antitumorwirkungen von RT in Kombination mit Checkpoint-Inhibitoren zu untersuchen, wurde eine Einzeldosis von 5 Gy zusammen mit Anti-mPD-1 oder Anti-mPD-L1-Antikörper eingesetzt. Unbehandelte und Isotyp-Kontrollgruppen zeigten überlappende Wachstumsraten und die Behandlung mit Einzelwirkstoff-Checkpoint-Inhibitoren Anti-mPD-1 und Anti-mPD-L1 löste keine Antitumor-Reaktion aus. Während eine Einzeldosis von 5 Gy RT zu einer Tumorwachstumsverzögerung von 9,5 Tagen gegenüber der unbehandelten Kontrollgruppe führte, trug die Kombination mit Checkpoint-Inhibitoren nicht signifikant zur Verbesserung der Antitumor-Reaktion bei. RT mit Anti-mPD-1 oder mit Anti-PD-L1 resultierte in einer Tumorwachstumsverzögerung von jeweils 13 und 11,2 Tagen (Abb. 6).
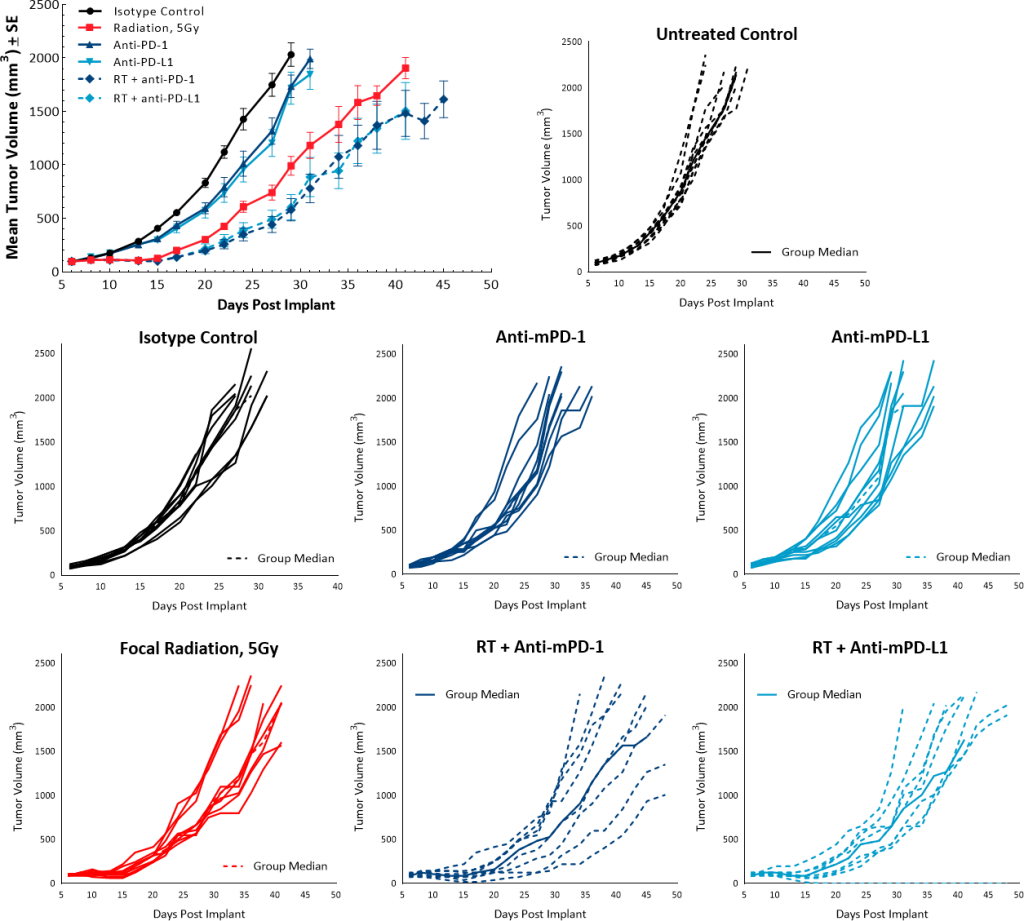
Abb. 6: Pan02-Reaktion auf eine Kombination aus Strahlung und Checkpoint-Inhibitoren.
Zukünftige Arbeit mit dem Pan02-Modell
Derzeit laufen Studien, um das Potenzial der Verwendung mehrerer Kombinationen zur Verbesserung des Ansprechens auf Behandlungen im subkutanen Pan02-Modell zu bewerten. Zusätzlich haben wir kürzlich eine Luciferase-fähige Pan02-Zelllinie generiert, um Studien in der orthotopen Umgebung zu unterstützen.
Verweise
2SEER Cancer Stat Facts. National Cancer Institute, NIH. (https://www.cancer.gov).
3Pancreatic Cancer Action Network (https://www.pancan.org/).
4Gunderson AJ, Yamazaki T, McCarty K et al. Blockade of fibroblast activation protein in combination with radiation treatment in murine models of pancreatic adenocarcinoma. Plos One 2019, 14(2): e0211117.
5Kabacaoglu D, Ciecielski KJ, Ruess DA and Algul H. Immune checkpoint inhibition for pancreatic ductal adenocarcinoma: current limitations and future options. Frontiers in Immunology 2018, 9:1876.
6Saung MT and Zheng L. Current standards of chemotherapy for Pancreatic cancer. Clin. Ther. 2017,39(11):2125–2134.
7Azad A, Lim SY, D’Costa Z et al. PD-L1 blockade enhances response of pancreatic ductal adenocarcinoma to radiotherapy. EMBO, Molecular Medicine 2017, 9(2):167–180.
8Lauffer DC, Kuhn PA, Kueng M et al. Pancreatic cancer: Feasibility and outcome after radio-chemotherapy with high dose radiotherapy for non-resected and R1 resected patients. 2018. Cureus 10(5): e2713.
9Javle M, Golan T and Maitra A. Changing the course of pancreatic cancer – focus on recent translational advances. Cancer Treatment Reviews. 2016; 44:17–25.
10Gajiwala S, Torgeson A, Garrido-Laguna I, Kinsey C, and Lloyd S. Combination immunotherapy and radiation therapy strategies for pancreatic cancer – Targeting multiple steps in the cancer immunity cycle. J Gastro Oncol, 2018; 9(6):1014–1026.
Unterhalten wir uns
Kontakt