Autor: Erin Trachet, Leitende wissenschaftliche Beraterin Onkologie | Senior Manager, Antragsentwicklung
Date: May 2017
Es wird geschätzt, dass im Jahr 2017 etwa 30.000 neue Fälle diagnostiziert werden und etwa 13.000 Patienten an Multiplem Myelom sterben werden. Es handelt sich jedoch um eine relativ seltene Krebsart mit einem Lebenszeitrisiko von 1 in 143 (0,7 %). Das Risiko, mit Multiplem Myelom diagnostiziert zu werden, steigt mit zunehmendem Alter, wobei die Mehrheit der Menschen damit im Alter 65 oder älter diagnostiziert wird. Männer haben ein etwas höheres Risiko, ein Multiples Myelom zu entwickeln, als Frauen, und Afroamerikaner haben ein doppelt so hohes Risiko, an dieser Krebsart zu erkranken. Der größte Risikofaktor für den Beginn der Diagnose mit Multiplem Myelom ist jedoch, bereits eine Plasmazellenerkrankung zu haben. Patienten mit monoklonaler Gammopathie von unbestimmter Bedeutung (MGUS) oder solitärem Plasmozytom werden früher oder später ein Multiples Myelom entwickeln.
Das multiple Myelom ist eine klonale B-Zell-Malignität, die durch die Akkumulation von terminal differenzierten, Antikörper produzierenden Plasmazellen im Knochenmark gekennzeichnet ist. Genetische Mutationen innerhalb der Myelomzellen und ihre Interaktion mit verschiedenen Zytokinen und Wachstumsfaktoren tragen zur Invasivität der Krankheit und zu erhöhter Wirkstoffresistenz bei. Die Patienten sind im Allgemeinen bis zu einem sehr späten Erkrankungsstadium asymptomatisch. Nachdem die Krankheit diagnostiziert wurde, wird häufig eine Lokalisierung, insbesondere in der Wirbelsäule, festgestellt. Gegenwärtig besteht die Goldstandard-Therapie aus einer Kombination von Doxorubicin und Dexamethason mit Bortezomib. Die Zugabe von Bortezomib verbessert die Gesamtansprechrate auf nahe 50 %.1
Eine häufig verwendete Zelllinie zur Evaluierung neuer Therapien für Multiples Myelom ist MM.1S. MM.1S wurde im Rahmen der Behandlung einer 42-jährigen, afroamerikanischen Frau diagnostiziert und wird für die CD25-, CD38-, CD52- und CD59-Expression genutzt. It also expresses the glucocorticoid receptor and is dexamethasone sensitive.2 In an effort to more effectively monitor in vivo disease progression, we transfected the MM.1S line with luciferase (MM.1S-pMMP-LucNeo). Mit Biolumineszenz-Bildgebung (BLI) können wir den zeitlichen Verlauf der disseminierten Krankheit überwachen und reproduzierbares In-vivo -Wachstum bei Mäusen finden (Abbildungen 1 und 2).
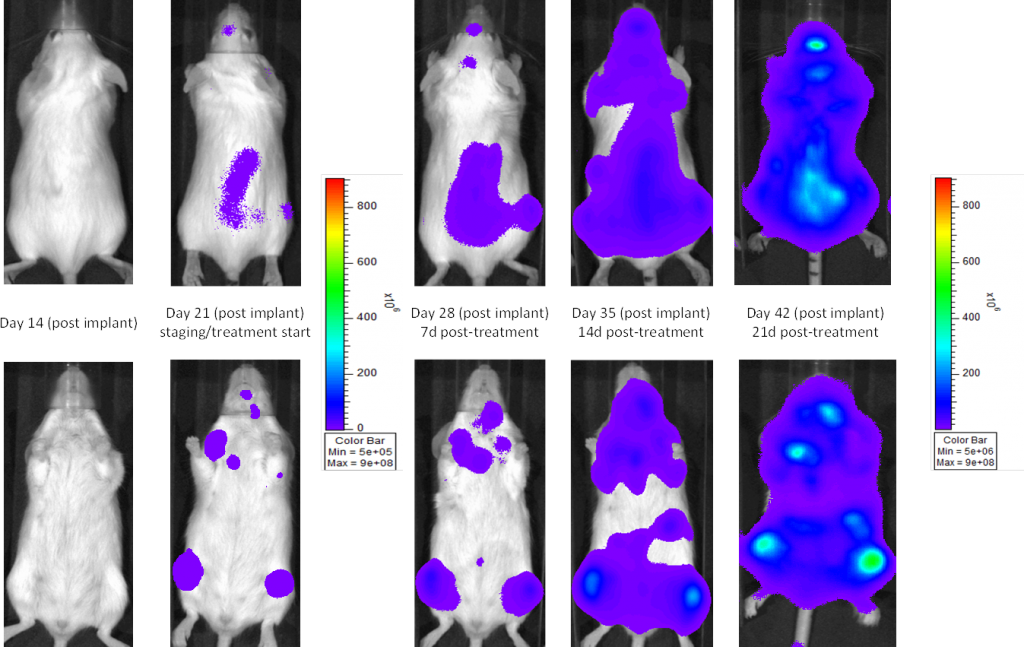
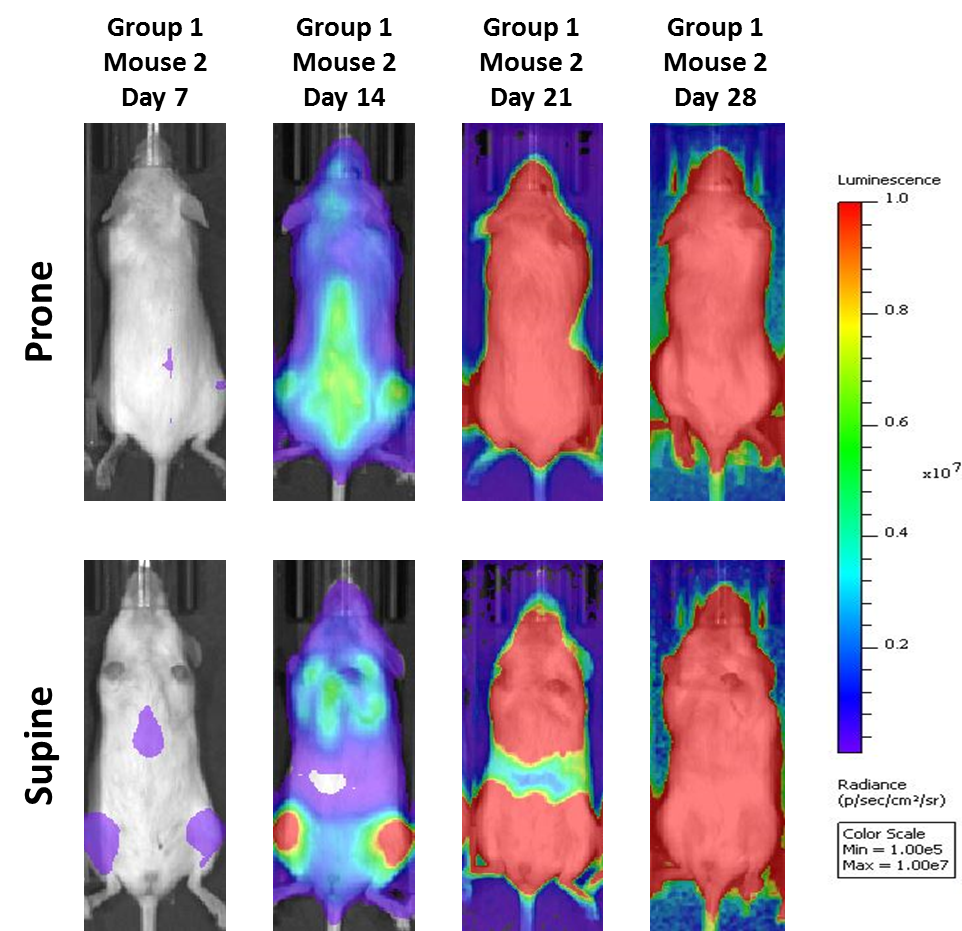
Abb. 2: MM.1 S-pMMP-LucNeo humanes Multiples Myelom in NSG-Mäusen: Repräsentative Bilder des Krankheitsfortschritts – Trägerkontrolle
BLI-Signal der mittleren Gesamttumorbelastung
Bei beigen SCID-Mäusen beträgt die mediane Verdopplungszeit des Tumorvolumens etwa 2 Tage (Abbildung 3) und die mediane Zeit bis zum Endpunkt Morbidität/Mortalität beträgt 35 bis 45 Tage. Um das MM.1S-pMMP-LucNeo-Modell weiter zu optimieren, haben wir das Wachstum im NSG-Mausstamm charakterisiert, der einen aggressiveren Krankheitsbeginn zeigt (Einstufung sieben Tage nach Implantation gegenüber 15 Tagen bei SCID-Mäusen). Bei NSG-Mäusen beträgt die Verdopplungszeit des Tumorvolumens um 1,8 Tage (Abbildung 4) und die mediane Zeit bis zum Endpunkt ca. 21 Tage, was ungefähr der Hälfte der Gesamtüberlebenszeit entspricht, die bei der beigen SCID-Maus beobachtet wurde.
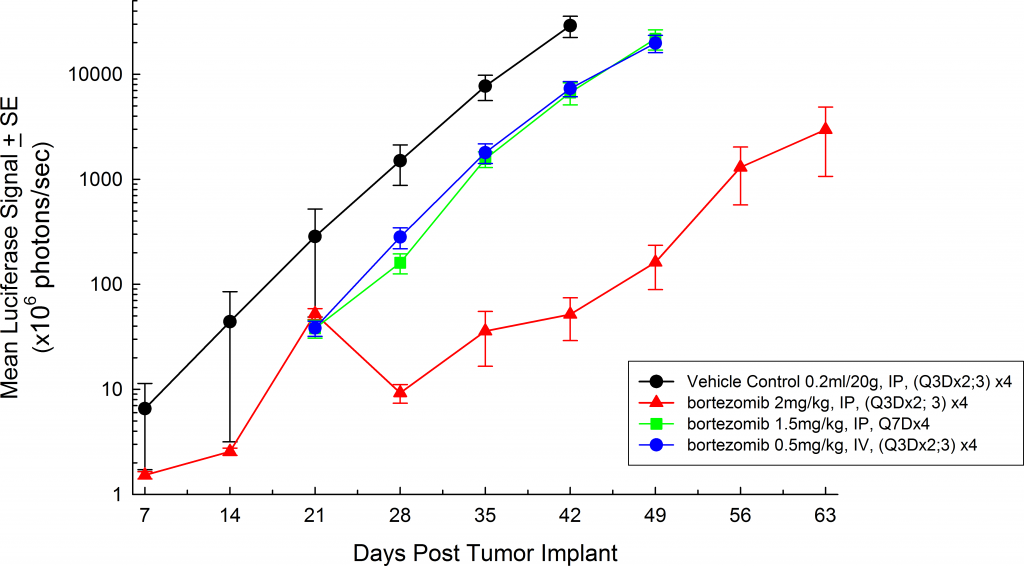
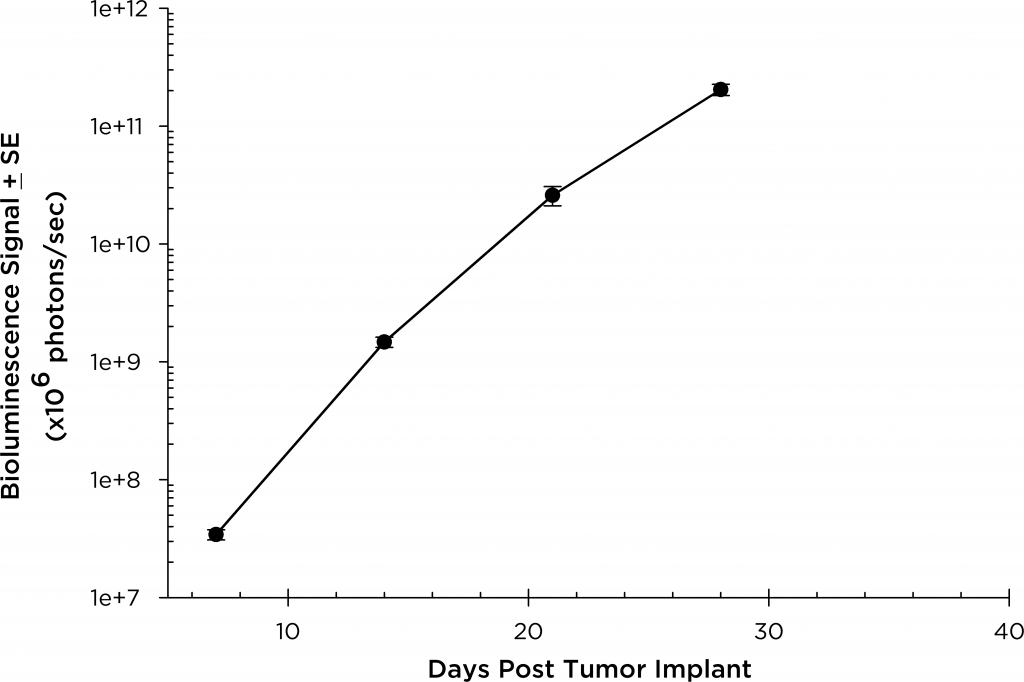
Abb. 3: MM.1 S-pMMP-LucNeo humanes Multiples Myelom bei beigen SCID-Mäusen: Mittlere Gesamt-Tumorbelastung BLI-Signal
Abb. 4: MM.1 S-pMMP-LucNeo humanes Multiples Myelom in NSG-Mäusen: Mittlere Gesamt-Tumorbelastung BLI-Signal
Mittlere Veränderung des Körpergewichts in Prozent
Bei allen Mausstämmen, die wir untersucht haben, sind die Tiere während der gesamten Studiendauer relativ asymptomatisch und zeigen erst im Spätstadium der Krankheit Symptome (Abbildungen 5 und 6); ähnlich wie die Krankheit sich beim Menschen manifestiert. Häufige klinische Symptome im Spätstadium bei Mäusen sind Lethargie und Lähmung. BLI bei diesen Tieren zeigen Lokalisierung des Signals in der Wirbelsäule, den Röhrenknochen und dem Unterkiefer. Bortezomib (Velcade®) als Einzelwirkstoff hat bei diesem Modell eine begrenzte Wirkung auf den Krankheitsverlauf. Dies ähnelt den Daten aus der Klinik, was darauf hindeutet, dass das Ansprechen auf die Behandlung verbessert werden kann, wenn Bortezomib in Kombination mit anderen Wirkstoffen verabreicht wird. Bei Berücksichtigung der Reproduzierbarkeit des Modells zusammen mit translatorischen Aspekten des Fortschreitens und Ansprechens der Krankheit bietet das MM.1S-Modell die Plattform für die Bewertung neuartiger Einzelwirkstoffbehandlungen wie auch von Wirkstoffkombinationen.
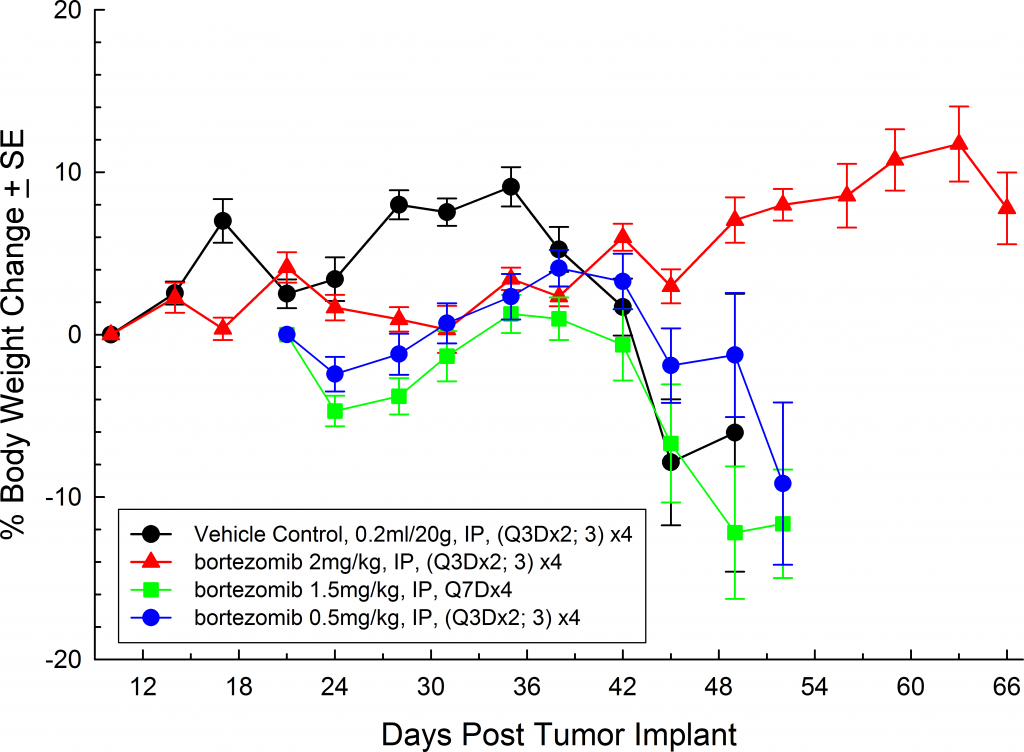
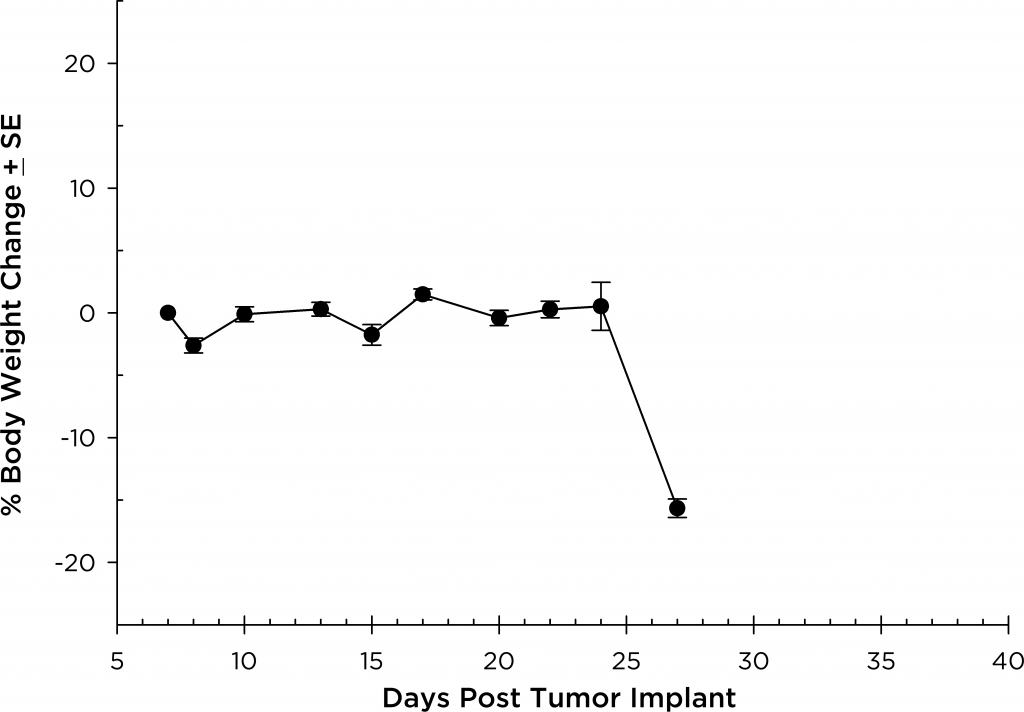
Fig. 5: MM.1S-pMMP-LucNeo human multiple myeloma in SCID Beige mice: Mean % Body Weight ChangeFig. 6: MM.1S-pMMP-LucNeo human multiple myeloma in NSG mice: Mean % Body Weight Change
Verweise
Unterhalten wir uns
Kontakt