Authors: Sheri Barnes, PhD | Director, Scientific Development &Maryland Franklin, PhD | Vice President, Scientific Development
Date: March 2019
Darmkrebs ist der vierthäufigste Krebs, der in den USA diagnostiziert wird. Darmkrebs ist die dritthäufigste Ursache für krebsbedingte Todesfälle bei Frauen und die zweithäufigste bei Männern. Im Jahr 2019 werden in den USA mehr als 145.000 geschätzte neue Fälle von Darmkrebs diagnostiziert, und es werden über 51.000 Todesfälle bei Patienten auftreten. Präventions- und Früherkennungsinitiativen in den letzten Jahrzehnten haben zusammen mit verbesserten Behandlungsoptionen zu einer Verringerung der Diagnose- und Todesfälle von Darmkrebs geführt. These measures have also increased the five-year overall survival rate to 64,9 %, but survival drops precipitously for those patients whose cancer is not detected early.[1] For this reason, the development of new treatments for colorectal cancer is a continual need.
Das Aufkommen der Immuntherapie hat syngene Maus-Tumormodelle mit wünschenswerter Wachstumskinetik und Reaktion auf immunmodulatorische Mittel erforderlich gemacht, um die Entwicklung immunonkologischer Behandlungen weiter voranzutreiben. One of these colon adenocarcinoma models, MC38, has been characterized by Labcorp to support development of these agents. MC38 wurde aus einem Dickdarmtumor in einer C57BL/6-Maus nach längerer Exposition gegenüber dem Karzinogen DMH (1,2-Dimethylhydrazindihydrochlorid) isoliert. [2] Wie nachstehend beschrieben, weist MC38 ein günstiges Antwortprofil auf immunmodulatorische Antikörper auf, was auf eine Tumormikroumgebung hinweist, die an die Immunaktivierung angepasst werden kann. Thus, MC38 is well positioned to be a powerful immuno-oncology model with significant utility in drug development
MC38-Tumoren nach Checkpoint-Inhibitor-Therapie
Die In-vivo-Verdopplungszeit von subkutanen MC38-Tumoren beträgt etwa 4 Tage, eine moderate Wachstumsrate, die es Testmitteln in einem bis zu einem dreiwöchigen Dosierungsfenster ermöglichen kann, ihre Antitumoraktivität auszulösen. Das Modell wurde in einer Studie verwendet, um die Reaktion auf häufig verwendete Checkpoint-Inhibitor-Antikörper zu bewerten. Abbildung 1 zeigt mittlere Tumorvolumina (A) und individuelle Tumorvolumina (BF) von unbehandelten Kontrolltumoren im Vergleich zu denen, die mit Isotypkontrolle, Anti-mCTLA-4, Anti-mPD-L1 oder Anti-mPD-1 behandelt wurden. Die Dosierung mit allen Testmitteln begann, sobald Tumore festgestellt wurden (~100 mm3). Anti-mPD-L1 und Anti-mPD-1 zeigten die bedeutendsten Antitumoraktivitäten der drei Checkpoint-Inhibitoren mit einer Verzögerung des Tumorwachstums von etwa 6 bzw. 8 Tagen am Tag 22, 40 % bzw. 50 % der mutmaßlichen Responder und einer erhöhte Zeit bis zum Fortschreiten von 32 bzw. 29 Tagen im Vergleich zur unbehandelten Kontrollgruppe. Die klare Wirkung dieser Behandlungen kann eine additive oder synergistische Verbesserung in Kombination mit Kandidatenmolekülen ermöglichen.
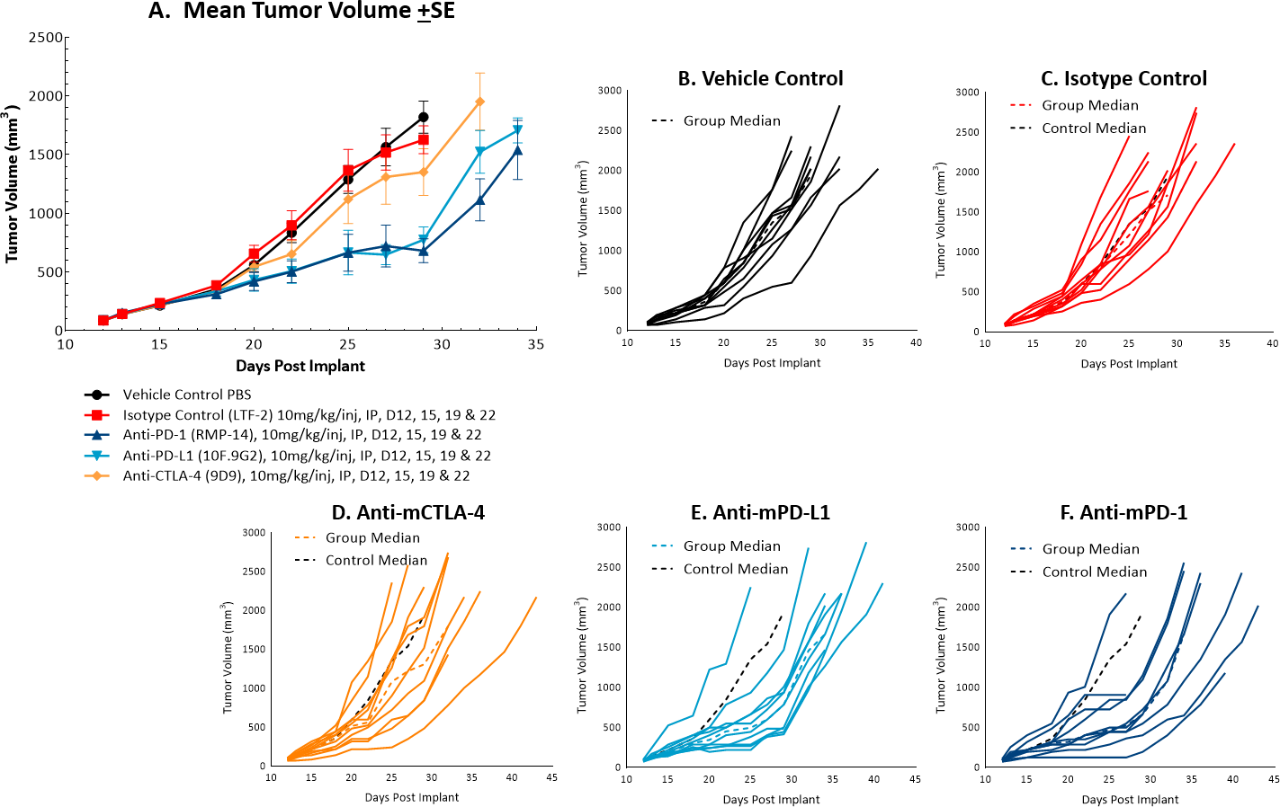
Abb. 1: Mittleres und individuelles Wachstum von MC38-Tumoren nach Checkpoint-Inhibitor-Therapie
MC38-Tumoren nach kostimulatorischer Antikörpertherapie
Die Reaktion von MC38 auf die kostimulatorischen Moleküle Anti-mOX40 und Anti-mGITR wurde ebenfalls bewertet, und wir fanden eine weniger robuste Antitumoraktivität im Vergleich zu den in Abbildung 1 dargestellten Reaktionen (siehe 2A und 2B–E). Die Behandlung mit Anti-mOX40 führte zu einer moderaten Antitumoraktivität mit 51 % medianem ΔT/ΔC am Tag 22, 10 % mutmaßlichen Respondern und einer Verzögerung des Tumorwachstums von 4,5 Tagen. Die Behandlung mit Anti-mGITR hatte die geringste Menge an Antitumoraktivität mit 72 % Median ΔT/ΔC am Tag 22, 20 % mutmaßlichen Respondern und 2 Tagen Verzögerung des Tumorwachstums. Es gibt jedoch auch Hinweise auf Aktivitäten, die Verbesserungspotenzial zeigen, was MC38 zu einem attraktiven Modell für die Kombinationstherapie mit einer Vielzahl von immunmodulatorischen Wirkstoffen macht.
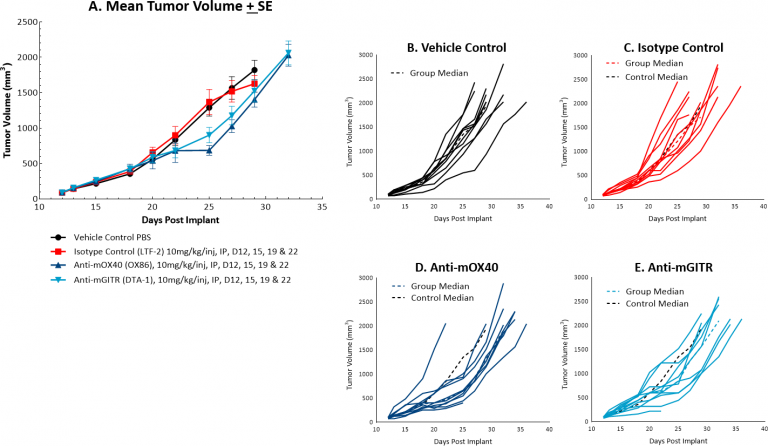
Abb. 2: Mittleres und individuelles Wachstum von MC38-Tumoren nach kostimulatorischer Antikörpertherapie.
MC38-Tumoren nach alleiniger fokaler Strahlentherapie oder in Kombination mit Anti-mPD-1
Die Strahlentherapie wird bei Dickdarmkrebs zwar nicht häufig angewendet, sie kann jedoch unter bestimmten Umständen zum Einsatz kommen, beispielsweise wenn versucht wird, einen Tumor vor der Operation zu verkleinern, oder in Kombination mit einer Chemotherapie bei Patienten, die für eine Operation möglicherweise nicht gesund genug sind. Im Vergleich wird Bestrahlung jedoch bei Mastdarmkrebs häufiger eingesetzt. We utilize the Small Animal Radiation Research Platform (SARRP, Xstrahl) to deliver focal beam radiation to murine models. Im subkutanen MC38-Modell haben wir eine einzelne fokale Dosis von 5, 10 oder 20 Gy getestet. Wir beobachteten eine Dosis-Wirkungs-Antitumoraktivität nach der Behandlung (Abbildung 3), wobei 5 Gy eine sehr geringe Aktivität, 10 Gy eine mäßige Aktivität und 20 Gy eine substantielle Aktivität ergab. In der Folgearbeit haben wir die Kombination von 10-Gy-Strahlung und Anti-mPD-1 im MC38-Tumormodell getestet (Abbildung 4). Wir fanden heraus, dass die Kombination zu verbesserten Antitumorreaktionen und zu 30 % tumorfreien Überlebenden führte, während die Monotherapien keine tumorfreien Überlebenden ergaben. Daher ist MC38 auch ein attraktives Modell, um Kombinationsansätze mit Strahlung zu testen.
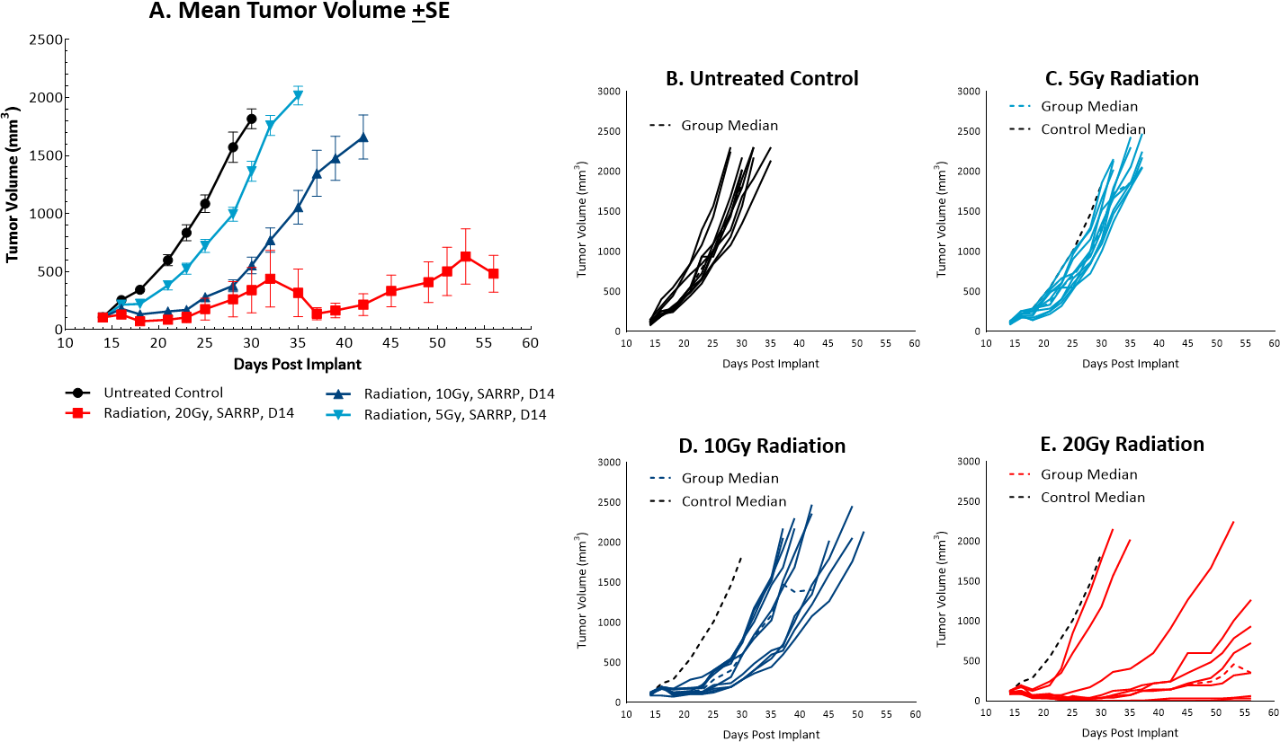
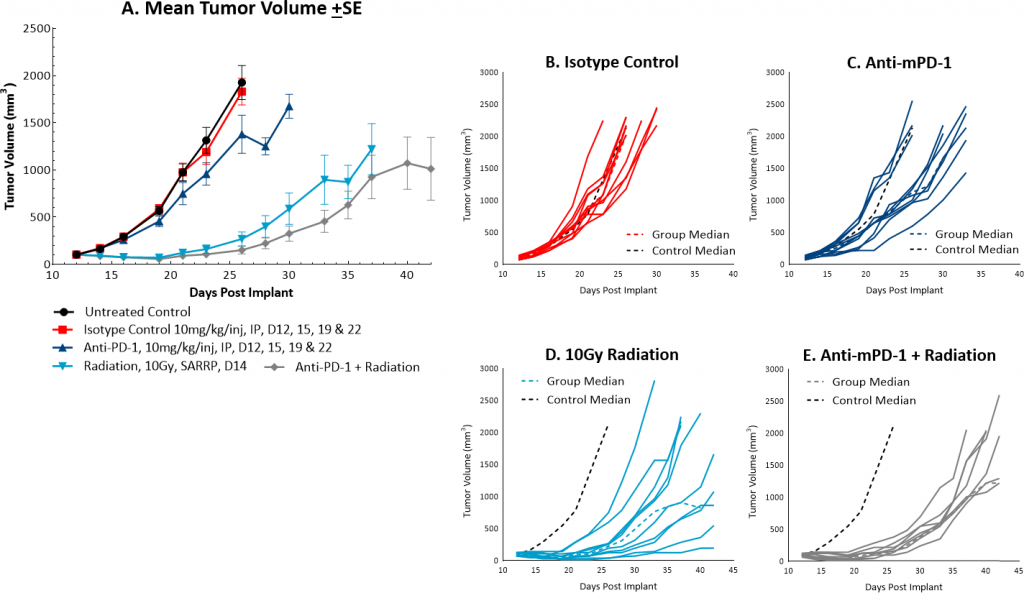
Abb. 4: Mittleres und individuelles Wachstum von MC38-Tumoren nach einer Kombinationsbehandlung mit Anti-mPD-1 und fokaler Strahlentherapie.
Das MC38-Kolonkarzinom-Mausmodell kann als robustes präklinisches, immunonkologisches Modell eingesetzt werden. Unsere Daten unterstützen die Verwendung dieses Werkzeugs bei der Untersuchung neuartiger Behandlungskombinationen mit Strahlung, Checkpoint-Inhibitoren, kostimulatorischen Molekülen oder anderen neuartigen Ansätzen.
Please contact us to speak with our scientists about how MC38 or one of our other syngeneic models can be used for your next immuno-oncology study.
Verweise
[2]Corbett TH, Griswold Jr, DP, Roberts JC, Peckham JC, Schabel, Jr, FM (1975) Tumorinduktionsbeziehungen bei der Entwicklung transplantierbarer Dickdarmkrebserkrankungen bei Mäusen für Chemotherapie-Assays mit einem Hinweis auf die Karzinogenstruktur. Cancer Research, 35: 2434-2439.
Unterhalten wir uns
Kontakt