Date: October 2019
Lungenkrebs ist die zweithäufigste Krebserkrankung, die sowohl bei Männern als auch bei Frauen in den USA diagnostiziert wird, und bei weitem die häufigste krebsbedingte Todesursache bei Männern und Frauen. Die American Cancer Society schätzt 2019, dass 228.150 neue Fälle von Lungenkrebs (116.440 bei Männern und 111.710 bei Frauen) diagnostiziert werden, und 142.670 Todesfälle durch Lungenkrebs (76.650 bei Männern und 66.020 bei Frauen) auftreten werden.
Die Zahl der durch Lungenkrebs verursachten Todesfälle erreichte 2005 mit 159.292 ihren Höhepunkt und ist seither allmählich zurückgegangen.[1] Die Fünf-Jahres-Überlebensrate bei Lungenkrebs liegt jedoch nur bei etwa 20 % und ist deutlich niedriger als bei anderen Krebsarten. Wenn Lungenkrebs früh erkannt wird, steigt die Fünf-Jahres-Überlebensrate auf ~56 %, aber nur ~16 % der Lungenkrebsfälle werden so früh erkannt. Für die Erkennung späterer Stadien kann die Fünf-Jahres-Überlebensrate bis zu 5 % betragen.
Es gibt viele Behandlungsmöglichkeiten für Lungenkrebs, je nachdem, welche Art von Lungenkrebs diagnostiziert wird und in welchem Stadium der Erkrankung man sich befindet. Alles von der Operation, Chemotherapie, Bestrahlung, gezielter Therapie und Immuntherapie wird klinisch eingesetzt. Zwar gibt es einige Erfolge, vor allem bei Patienten mit bestimmten Genmutationen und in jüngster Zeit mit neueren Immuntherapien, aber die Gesamtprognose ist immer noch schlecht. Daher ist die kontinuierliche Entwicklung neuer Therapien für Lungenkrebs erforderlich.
Das Aufkommen der Immuntherapie hat syngenetische Maustumormodelle erforderlich gemacht, um die Entwicklung von Immunonkologie-Behandlungen weiter voranzutreiben. One of these models is the LL/2 (Lewis Lung) lung carcinoma model that has been characterized by Labcorp to support development of novel agents. Die LL/2-Zelllinie wurde aus einem Primärtumorknötchen aus dem Lewis-Lungenkarzinom-Modell entwickelt, das sich spontan als Epidermoidkarzinom in der Lunge einer C57BL-Maus entwickelt hatte. Wie unten dargestellt, wird LL/2 als „kalter“ Tumor mit geringer Infiltration von T-Zellen und hoher Infiltration myeloischer suppressiver Zellen klassifiziert. Da viele Krebspatienten auf die derzeitigen Immuntherapien nicht ansprechen, ist das Verständnis „kalter“ Tumormodelle ein wichtiger Teil der Entwicklung und Nutzung syngener Mausansätze für die Wirkstoffentdeckung und -entwicklung.
LL/2 Tumor-Immunprofil
Baseline immune profile of LL/2 tumor infiltrates was determined on 6 untreated tumors (~500mm3) analyzed with the Labcorp CompLeukocyteTM Package. Von den CD45+ Zellen, die diese Tumore infiltrieren, stellten die M-MDSCs die größte Zellpopulation dar (37 %), gefolgt von G-MDSCs (22 %) und M2 TAMs (20 %). T-Zellen (sowohl CD8+ als auch CD4+), zusammen mit M1 TAMs, B-Zellen, NK, NKT und dendritische Zellen waren minimal vertreten (Abb. 1). Das Gesamtprofil lässt auf ein nicht-immunogenes Modell schließen.
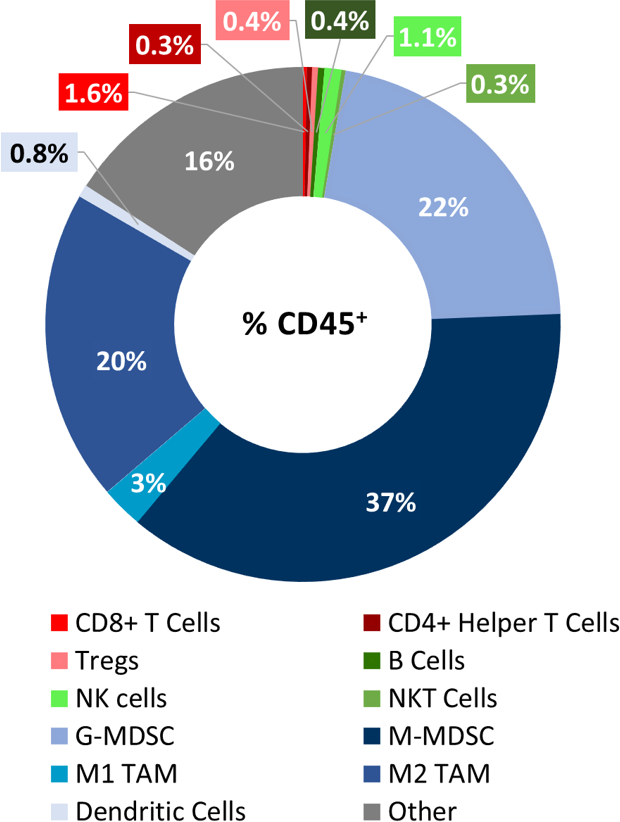
Abb. 1: Immunphänotypisierung von Tumor-Immunzell-Infiltraten im LL/2 Modell.
LL/2 Wachstum und Reaktion auf Therapie
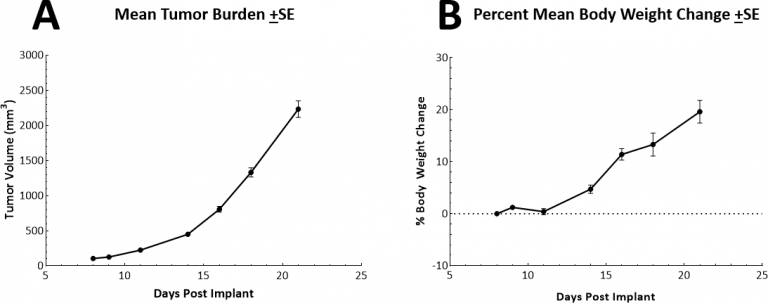
Die in-vivo Verdopplungszeit von subkutanen (SC) LL/2 Tumoren ist mit etwa 2,5–3 Tagen sehr schnell. Daraus ergibt sich ein Modell, das ein bis zu zweiwöchiges Dosierungsfenster für Test-Agenzien ermöglicht, um deren Anti-Tumor-Aktivität auszulösen. Das Modell selbst führt nicht zu einer Reduktion des Körpergewichts (Abb. 2A, 2B).
Es gibt eine Vielzahl von Chemotherapie-Ansätzen für Lungenkrebs, und zu diesem Zweck haben wir sowohl Doxorubicin als auch Paclitaxel als Einzelwirkstoffe im LL/2-Modell getestet. Doxorubicin ist ein Anthracyclin, das ein breites Spektrum an Anti-Tumor-Aktivität aufweist, und Paclitaxel ist ein tubulinbindender Wirkstoff, der häufig zur Behandlung von nicht-kleinzelligem Lungenkrebs (NSCLC) eingesetzt wird. Im LL/2-Modell zeigte keines der beiden Testmittel bei der von uns untersuchten Dosis und den untersuchten Zeitplänen aussagekräftige Anti-Tumor-Reaktionen (Abb. 3A und B).
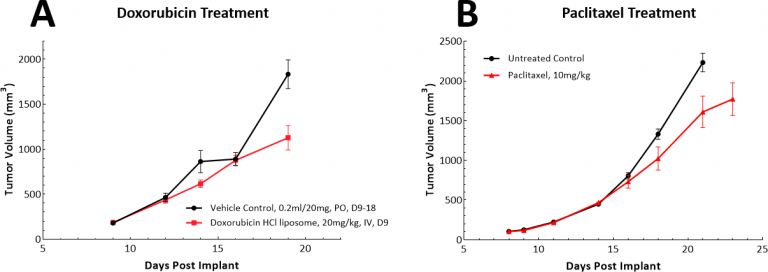
Abb. 3: Antwort von LL/2 SC-Tumoren auf eine Monotherapie mit Doxorubicin oder Paclitaxel.
Mit dem Aufkommen der Immuntherapie haben wir auch untersucht, ob das LL/2-Modell auf Einzelwirkstoff-Kontrollpunkt-Inhibitoren, anti-PD-1 oder anti-PD-L1 (Abb. 4) ansprechen würde.. Abb. 4 zeigt die mittleren Tumorvolumina (Abb. 4A) und die individuellen Tumorvolumina (Abb. 4B, C, und D) nach Behandlung mit Isotypenkontrolle, anti-PD-1 oder anti-PD-L1. Die Dosierung mit allen Testmitteln begann, sobald Tumore festgestellt wurden (~100 mm3). Es überrascht nicht, dass keines der beiden Testmittel aufgrund der hoch immunsuppressiven Tumormikroumgebung in diesem Modell einen therapeutischen Nutzen zeigte. Wir postulierten dann, ob die Kombination von Paclitaxel mit Immunkontrollpunkt-Inhibitoren einen Kombinationsnutzen bringen würde (Abb. 5A und B). Dieser Ansatz führte jedoch nicht zu einem verbesserten Ergebnis bei den Mäusen, was die Position vollständig festigte, dass das Modell einen „kalten“ Phänotyp aufweist. Es ist möglich, dass Dreifach-Kombinationsansätze in diesem Modell von Nutzen sein könnten, und diejenigen, die nach Ansätzen zur Behandlung „kalter“ Tumore suchen, würden dieses Modell nützlich finden.
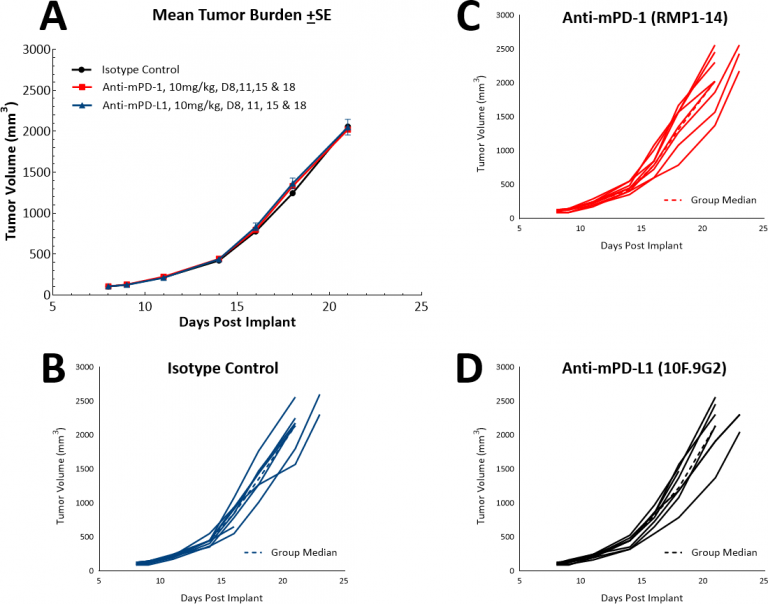
Abb. 4: Antwort von LL/2 SC-Tumoren zu Einzelwirkstoff-Kontrollpunkt-Inhibitoren anti-mPD-1 und anti-mPD-L1.
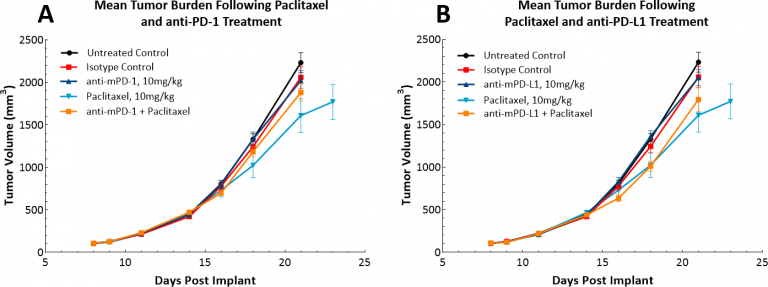
Abb. 5: Antwort von LL/2 SC-Tumoren zur Kombinationsbehandlung mit Checkpoint-Inhibitoren und Paclitaxel.
LL/2 Tumore nach lokalisierter Strahlentherapie allein oder in Kombination mit Anti-PD-1
Bei Lungenkrebspatienten wird die Strahlentherapie häufig sowohl allein, als palliative Monotherapie, als auch in Kombination mit einer Chemotherapie eingesetzt. While focal radiation is highly recommended, we have utilized our RadSource RS-2000 to deliver localized radiation in a few models. Im subkutanen LL/2-Modell testeten wir eine einzelne hohe Dosis (20Gy) lokalisierter Strahlung an Mäusen mit in die Sakralregion implantierten SC-Tumoren. Wir stellten fest, dass die Bestrahlung allein die Zeit bis zur Evaluierungsgröße auf 36 Tage erhöhte, gegenüber 20 Tagen in der Kontrollgruppe. Mit dem Zusatz von anti-PD-1 erhöhte sich die Zeit bis zur Evaluierung geringfügig auf 38,5 Tage, was auf keinen zusätzlichen Nutzen der Kombinationsbehandlung schließen lässt (Abb. 6). In diesem Modell könnte jedoch eine Dreifachkombination aus Bestrahlung, Immunkontrollpunktblockade und einer neuartigen Therapie weiter getestet werden.
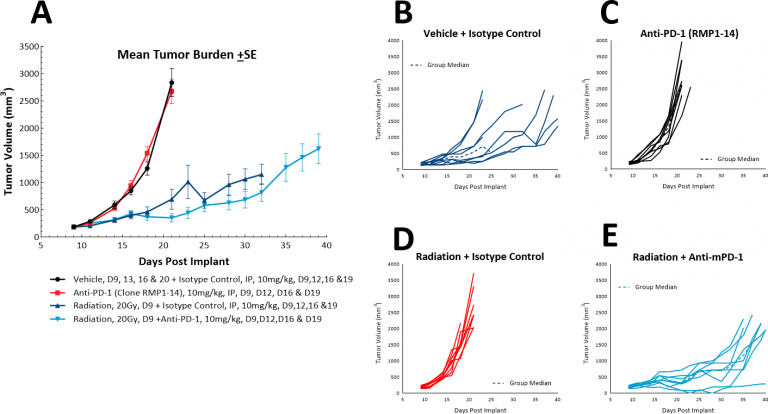
Abb. 6: Antwort von LL/2 SC-Tumoren zur Kombinationsbehandlung mit lokalisierter Bestrahlung und anti-PD-1.
Subkutane Tumormodelle sind nützlich für eine schnelle und relativ einfache Beurteilung der Anti-Tumor-Aktivität. Aufgrund der Art der Implantationsstelle können diese Tumore jedoch möglicherweise nicht die gesamte erforderliche Biologie replizieren, die die Krankheit beim Patienten besser repräsentieren würde. Zu diesem Zweck haben wir eine Luziferase-fähige Version von LL/2, LL/2-Luc-M38, die zur Entwicklung des LL/2-Modells in der orthotopen Lungenumgebung verwendet wird.
Das LL/2 Maus-Lungenkarzinom-Modell kann als präklinisches immunonkologisches Modell eingesetzt werden. Unsere Daten unterstützen den Nutzen dieses Werkzeugs bei der Untersuchung neuartiger Behandlungskombinationen mit Bestrahlung oder Checkpoint-Inhibitoren oder anderen neuartigen Ansätzen zur Behandlung von „kalten“ nicht-immunogenen Tumoren.
Bitte contact us to speak with our scientists about how LL/2 or one of our other syngeneic models can be used for your next immuno-oncology study.
Verweise
Unterhalten wir uns
Kontakt