Autor: Sumithra Urs, PhD | Wissenschaftlerin, Wissenschaftliche Entwicklung
Date: October 2018
Hepatocellular carcinoma (HCC) is an aggressive malignancy which has gradually increased in incidence to affect one million people worldwide and is currently the third leading cause of cancer related deaths in the world.[1,2] The prevalence of HCC is highest in Asia and Africa due to high endemicity of hepatitis B and C viruses which strongly predispose to the development of chronic liver disease and subsequent HCC.[1]
In the Western population, hepatitis C, alcoholic cirrhosis, and non-alcoholic steatohepatitis (NASH) are the main underlying causes. Während zu den Behandlungsoptionen im frühen Stadium des HCC chirurgische Exzision, Lebertransplantation, Chemo-/Radioembolisation und Radiofrequenzablation gehören, sind die Standardbehandlung bei fortgeschrittenem HCC gezielte Therapien (Sorafenib und Regorafenib), Bestrahlung und Chemotherapie (Doxorubicin, 5-FU und Cisplatin).[3] Es laufen zahlreiche klinische Studien für inoperables oder fortgeschrittenes HCC mit Mono- oder Kombinationsimmuntherapie, monoklonalen Antikörpern oder onkolytischer Virustherapie.[1-4] Diese Therapien haben eine Schrumpfung des Tumors und eine Verbesserung der Überlebenschancen gezeigt, sind jedoch nicht kurativ, wobei der Behandlungserfolg von bereits bestehenden Erkrankungen wie Hepatitis, Leberzirrhose oder der nichtalkoholischen Fettleberkrankheit (NAFLD) abhängt. Daher besteht ein ständig wachsender Bedarf an besseren Behandlungsmöglichkeiten. To evaluate novel therapies in a preclinical platform, Labcorp has established the syngeneic HCC model Hepa 1-6.
Hepa 1-6 ist ein murines Hepatom, das vom BW7756 Hepatom-Tumor abgeleitet wurde, das spontan in C57L/J-Mäusen entstanden ist, was im Gegensatz zu den meisten verfügbaren Hepatom-Modellen steht (BNL, A. 7R.1, MH-129, MH134 und MH-22A), die chemisch transformierte oder induzierte Linien sind. Das in immunkompetenten Mäusen entstandene Hepa 1-6-Tumormodell stellt ein klinisch relevantes Modell für die präklinische Prüfung der Immuntherapie dar.
In this model spotlight we present in vivo data on Hepa 1-6 tumor model growth kinetics; along with response to checkpoint inhibitors alone or in combination with focal radiation. Wir haben das Modell mit seinem elterlichen C57L/J-Stamm (nur begrenzt verfügbar bei The Jackson Laboratories, Bar Harbor, ME) und dem leichter verfügbaren, histokompatiblen C57BL/6-Stamm geprüft.
Hepa 1-6 Wachstumsparameter
Die Wachstumskinetik nach subkutanem Implantat zeigt, dass sich das Modell in beiden Mausstämmen erfolgreich etabliert. (Abb. 1). Die Tumore haben eine durchschnittliche Verdopplungszeit von ~5-6 Tagen ohne nachteilige Veränderungen des Körpergewichts (Daten nicht angezeigt). Diese stetige Wachstumsrate ermöglicht ein dreiwöchiges therapeutisches Fenster zur Beurteilung der Anti-Tumor-Reaktionen.
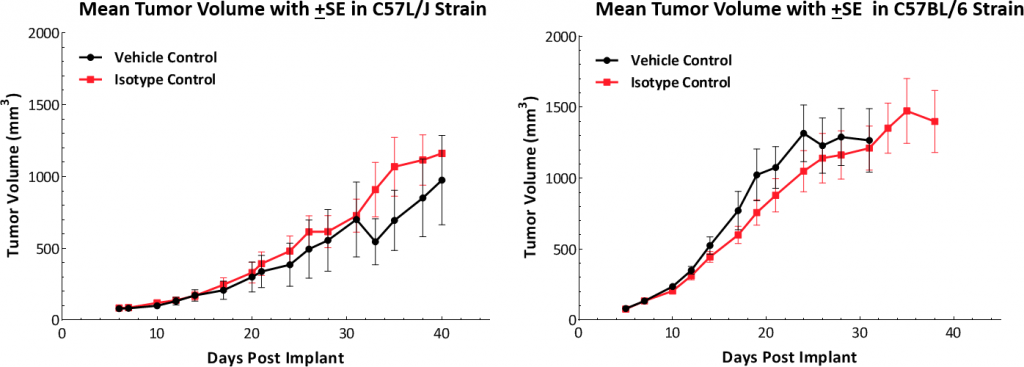
Abb. 1: Hepa 1-6-Tumorwachstumskinetik bei C57L/J und C57BL/6-Mäusen.
Hepa 1-6-Tumor-Immunprofile
Um das Immunprofil der Hepa 1-6-Tumore zu verstehen, wurde die Zusammensetzung des Ausgangsimmunsystems mittels Durchflusszytometrie analysiert und ist in Abb. 2 dargestellt. Das Immunprofil wurde anhand von fünf unbehandelten Hepa 1-6-Tumoren, die im C57L/J-Stamm gewachsen waren, bis zu einem Volumen von ~750-1000mm3 erstellt. Tumore haben eine relativ hohe CD45+ Zellpopulation (durchschnittlich ~60}%), bei denen die T-Lymphozyten (CD8+ T-Zellen und CD4+ T-Helferzellen) aber nur mäßig vertreten waren (durchschnittlich ~11 % bzw. ~6 %). Die myeloische Population wurde überwiegend durch G-MDSC (Mittelwert ~30 %), gefolgt von M-MDSC (Mittelwert ~11 %) dargestellt. Die CD8+ T-Zell-Infiltration innerhalb der Tumormikroumgebung deutet auf ein immunologisch ansprechendes oder „warmes“ Tumormodell hin.
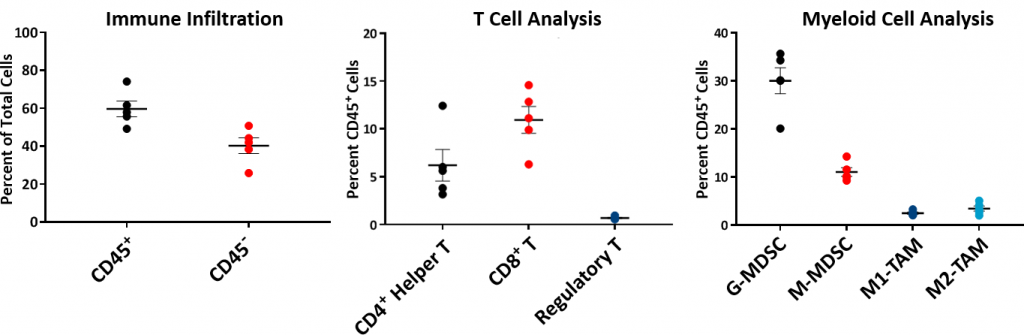
Fig. 2: Baseline Hepa 1-6 Tumor Immunprofile bei C57L/J -Mäusen
Hepa 1-6-Reaktion auf Checkpoint-Hemmer
Die Reaktion von Hepa 1-6 auf immunmodulatorische Wirkstoffe wurde bei etablierten Tumorträgern (mittleres Tumorvolumen ~100mm3) C57BL/6-Mäusen untersucht, die mit Checkpoint-Blockade-Antikörpern (anti-mPD-1) anti-mPD-L1, und anti-mCTLA-4) behandelt wurden. Die Kontrollen, Träger (PBS) und Isotyp (Ratten-IgG2b-Klon LTF-2}), zeigten eine vergleichbare Wachstumskinetik (Abb. 1). Die Einzelwirkungs-Checkpoint-Inhibitoren anti-mPD-1 und anti-mCTLA-4} lösten eine starke Reaktion aus, die zu einer vollständigen Tumorregression (CR) und zu 100 % tumorfreien Überlebenden (TFS) führte. Die Anti-mPD-L1-Behandlung zeigte auch bei einer Untergruppe von Tieren eine guten Reaktion, was zu CR und 5/10 TFS führte (Abb. 3). Die Behandlung mit Checkpoint-Hemmstoff-Antikörpern war nicht mit signifikanten Veränderungen des Körpergewichts im Vergleich zu den Kontrolltieren verbunden (Daten nicht gezeigt). Die Reaktion auf die Immuntherapie unterstützt nachdrücklich die Charakterisierung von Hepa 1-6-Tumoren als immunologisch „heiß“.
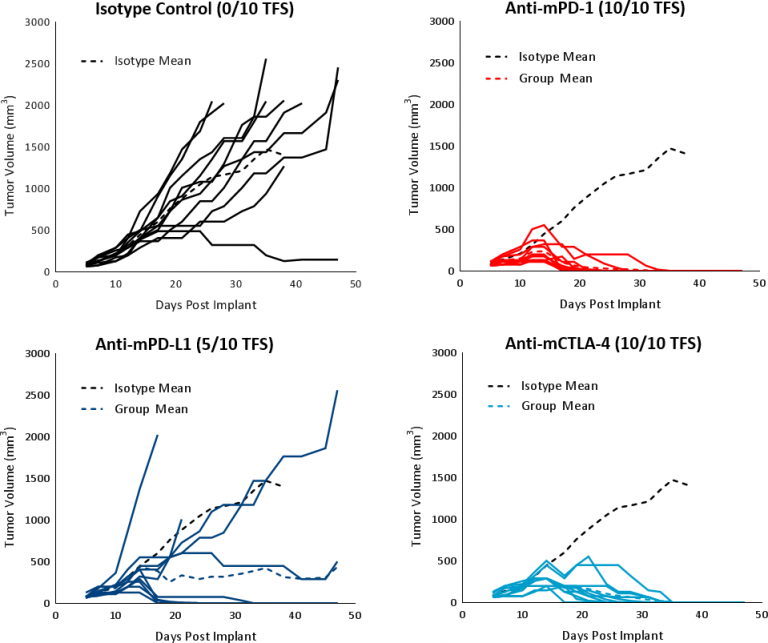
Abbildung 3: Hepa 1-6 Tumorreaktion auf Checkpoint-Hemmstoffe bei C57BL/6-Mäusen.
Reaktion auf fokale Strahlung
Klinisch gesehen erhalten Patienten mit nicht-metastasiertem HCC eine oder mehrere die Leber betreffende Therapien (LDT) wie Strahlentherapie (RT) oder stereotaktische Körperbestrahlungstherapie (SBRT).[5] RT kann zu einer Tumorschrumpfung führen und das Mikroumfeld des Tumors in ein günstiges tumorunterdrückendes Milieu verändern. Um die Reaktion von Hepa 1-6-Tumoren auf RT zu testen, verwendeten wir die Small Animal Radiation Research Platform (SARRP; Xstrahl), um fokale Strahlung auf die Zielbereiche zu richten. Fokale Strahlungsdosen von 5 und 10 Gy wurden an subkutanen Hepa 1-6-Tumoren in C57BL/6-Mäusen getestet. Die Behandlung zeigte eine dosisabhängige Reaktion und führte zu einer Verzögerung des Tumorwachstums (TGD) von >20 Tagen und zu tumorfreien Überlebenden (2/10 bzw. 8/10}) (Abb. 4). Eine Dosis von 5 Gy führte zu einer moderaten Reaktion auf die Monotherapie mit verlängerter Lebensdauer und wird für zukünftige Kombinationsstudien empfohlen.
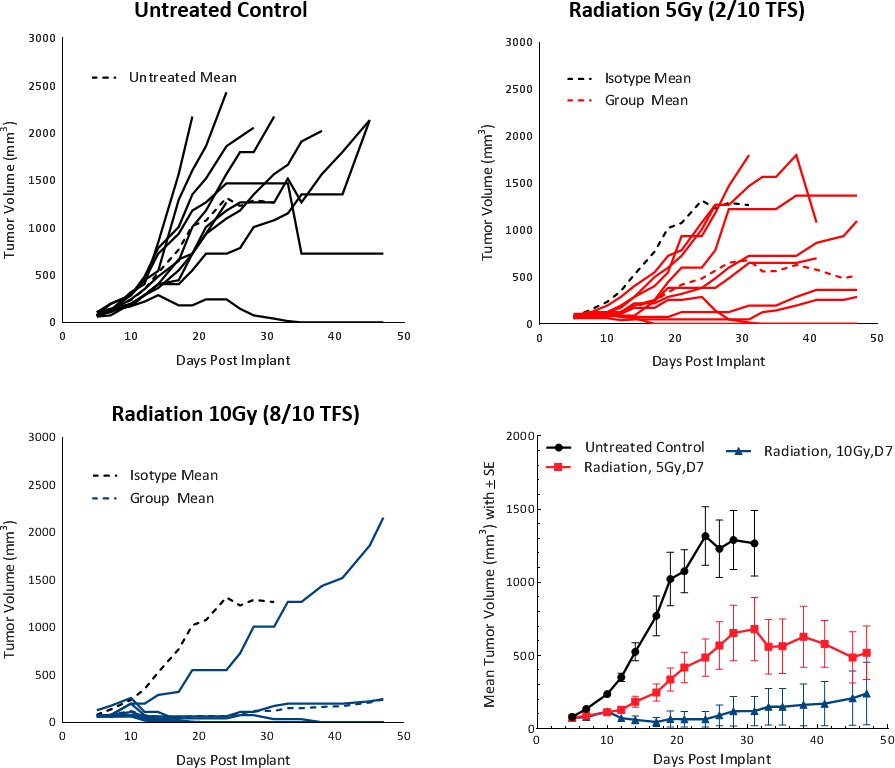
Abbildung 4: Hepa 1-6 Tumorreaktion auf Strahlenbehandlung bei C57BL/6-Mäusen.
Hepa 1-6-Reaktion auf Sorafenib
Sorafenib, ein Multi-Tyrosinkinase-Hemmstoff, der die Aktivität von Raf-Kinase-, Src-, VEGF- und PDGF-Rezeptoren blockiert und als Erstlinienbehandlung bei HCC-Patienten eingesetzt wird, wurde an Hepa 1-6-Tumoren getestet. Die Behandlung führte zu einer Verzögerung des Tumorwachstums von 25,4 Tagen und verlängerte das Gesamtüberleben, führte aber zu keiner TFS (Abbildung 5). Diese Ergebnisse sind vergleichbar mit Ergebnissen aus klinischen Studien, die eine teilweise Reaktion zeigten, wonach die durchschnittliche Gesamtüberlebenszeit von 7,9 Monaten in der Kontrollgruppe auf 10,7 Monate in der behandelten Gruppe verlängert wurde.[1]
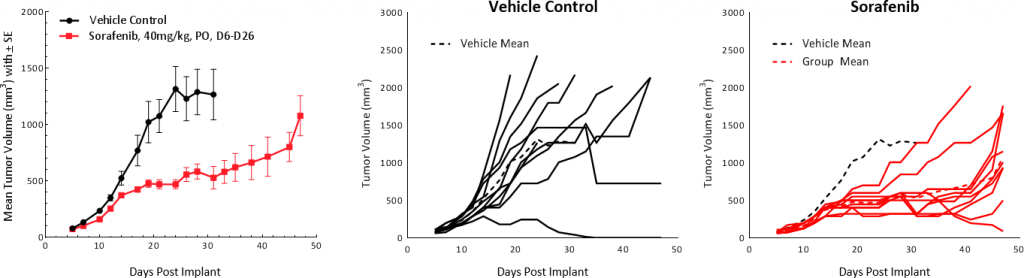
Abbildung 5: Hepa 1-6 Tumorreaktion auf Sorafenib-Behandlung bei C57BL/6-Mäusen.
Diese vorläufigen Daten deuten darauf hin, dass das Hepa 1-6-Modell des HCC ein günstiges Immunprofil aufweist und als robustes präklinisches Immuno-Onkologie-Modell eingesetzt werden kann. Unsere Daten unterstützen den Einsatz dieses Modells bei der Untersuchung von Immuntherapeutika als Monotherapie oder in Kombination mit Bestrahlungen, kleinen Molekülen, Behandlungsstandards und anderen neuartigen Therapeutika.
Please contact us to speak with our scientists about how Hepa 1-6 can be used for your next immuno-oncology study.
Verweise
[1]Medavaram, S und Zhang Y, 2018. Emerging therapies in advanced hepatocellular carcinoma. (Neue Therapien bei fortgeschrittenen hepatozellulären Karzinomen) Exp Hematol Oncol 7:17.
[2]Llovet JM, Montal R, Sia D und Finn RS, 2018. Molecular therapies and precision medicine for hepatocellular carcinoma. (Molekulare Therapien und Präzisionsmedizin beim Leberzellkarzinom) Nat Rev Clin Oncol. doi: 10,1/s41571-018-0073-4. [E-Publikation vor Drucklegung] PMID:30061739.
[3]Pinter M & Peck-Radosvljevic M. 2018. Review article: systemic treatment of hepatocellular carcinoma. 2018. (Übersichtsartikel: Systemische Behandlung des hepatozellulären Karzinoms.) Aliment Pharmacol Thera, Jul 23. doi: 10,11/apt.14913. [E-Publikation vor Drucklegung] PMID: 30039640.
[4]Waidmann O. 2018. Recent developments with immunotherapy for hepatocellular carcinoma. (Neuere Entwicklungen bei der Immuntherapie des hepatozellulären Karzinoms.) Expert Opin Biol Ther. Aug;18(8):905-910.
Unterhalten wir uns
Kontakt