Date: February 2021
Successful treatment of breast cancer by immunotherapy continues to be a challenge, but emerging clinical data is encouraging.3 To help enable preclinical research of immunotherapy in breast cancer, we have developed the orthotopic EMT6 syngeneic breast tumor model in 2018.
The EMT6 model was derived from a transplanted hyperplastic alveolar metastatic lung nodule in BALB/c mice.4 As further data was generated with this model, observations of metastatic foci in the lung visible upon gross necropsy occurred in up to 40 % of control mice. As metastasis is common in breast cancer patients, it was important to take advantage of this finding, so a luciferase enabled EMT6 cell line (EMT6-Luc) was generated to monitor thoracic metastasis by bioluminescence imaging (BLI) in-vivo. For this project, animal care and use was conducted according to animal welfare regulations in an AAALAC-accredited facility with IACUC protocol review and approval.
In diesem Spotlight präsentieren wir Daten aus unserer ersten Wirksamkeitsstudie mit dem in das Brustfettpolster (MFP) implantierten EMT6-Luc-Modell, sowohl durch Messung der Dicke des Primärtumors als auch durch BLI des Brustbereichs zur Überwachung des Fortschreitens der Metastasenbildung. Kontrolldaten für das Tumorwachstum für die EMT6- und EMT6-Luc-Modelle sind in Abbildung 1 dargestellt. Sowohl für das Eltern- als auch das EMT6-Luc-Modell beträgt die mittlere Verdopplungszeit von MFP-Tumoren 5,5 Tage, was ein Behandlungsfenster von zwei bis drei Wochen zur Bewertung der Antitumoraktivität von Testmitteln bereitstellt.

Abbildung 1. Individuelles Kontrollwachstum von EMT6 (A) und EMT6-Luc (B), das orthotop (Brustfettpolster) in weibliche Balb/c-Mäuse implantiert wurde.
Um die Reaktion von EMT6-Luc auf eine Blockierung des Checkpoints zu bestimmen, wurden Mäuse mit EMT6-Luc-Tumoren mit Anti-mPD-1 oder Anti-mPD-L1 behandelt. Die Reaktionen auf die Blockierung des Checkpoints waren im Vergleich zur Kontrollgruppe moderat (Abbildung 2), und die Reaktionen auf Anti-mPD-1 in EMT6-Luc waren den aus der Elternlinie generierten Daten ähnlich (Tabelle 1). Die Reaktion auf Anti-mPD-L1 scheint bei EMT6-Luc im Vergleich zu der Elternlinie (Tabelle 1) leicht verbessert zu sein, aber die Gesamtwirkung der Zugabe des Luciferase-Tags in Bezug auf die Antitumorwirksamkeit erscheint unter den getesteten Bedingungen minimal.
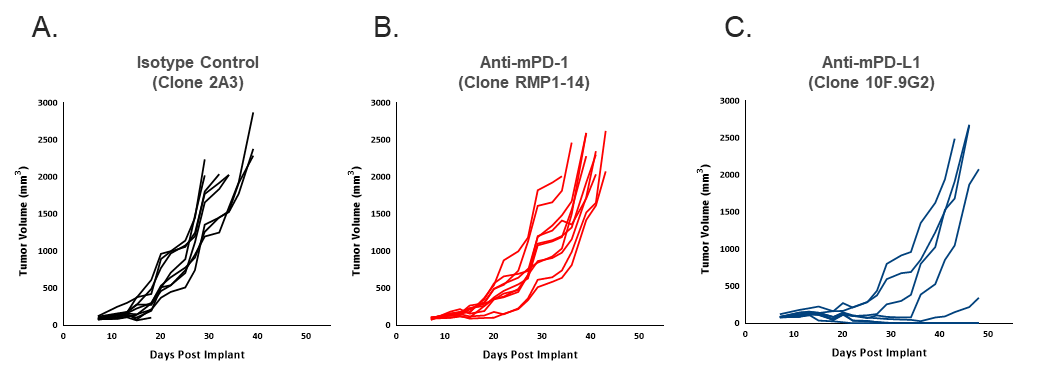
Abbildung 2. Individuelle EMT6-Luc-Tumorvolumenmessungen, die die Antitumorwirksamkeit von Anti-mPD-1 (B) und Anti-mPD-L1 (C) im Vergleich zur Isotyp-Kontrollgruppe (A) verdeutlichen. Jeder Antikörper wurde zweimal wöchentlich mit 10 mg/kg dosiert.
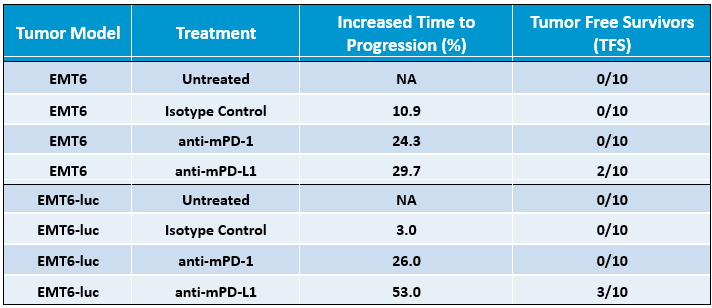
Tabelle 1. Unterschiedliche Reaktionen von EMT6 und EMT6-Luc-Tumormodellen mit Reaktion auf die Checkpoint-Hemmung durch Anti-mPD-1 und Anti-mPD-L1. Der verlängerte Endpunkt der Zeit bis zum Fortschreiten basiert auf der Zunahme der Anzahl der Tage zwischen dem Beginn der Behandlung und dem Tag des Austritts der Tiere aus der Studie im Vergleich zu unbehandelten Tumoren.
Zusätzlich zur Bewertung des Ansprechens auf die Behandlung durch primäre MFP-Tumormaßnahmen ermöglicht die Luciferase-fähige Zelllinie auch die Überwachung der Entwicklung von Metastasen im Brustkorb durch Bewertung der BLI-Signallokalisation in-vivo. Die Entwicklung des Signals im Brustkorb ist in Abbildung 3 dargestellt. Wie erwartet bietet die Überwachung durch BLI eine zusätzliche Granularität hinsichtlich des Ausmaßes der Metastasenbildung sowie einer Verzögerung der metastatischen Beteiligung bei der Behandlung mit Anti-mPD-1 oder Anti-anti-mPD-L1. Alle Kontrolltiere zeigten während der Studie ein zunehmendes BLI-Signal im Brustkorb, aber keines dieser Tiere wies bei der Autopsie Metastasen auf (Daten nicht gezeigt). Während eine pathologische Bewertung erforderlich ist, um die Ätiologie eines zunehmenden Signals im Brustkorb zu bestätigen, deuten historische Beobachtungen von Lungenknoten bei der Autopsie von unbehandelten Tieren stark darauf hin, dass das zunehmende Signal auf Metastasen zurückzuführen ist, was den Wert dieses Endpunkts hervorhebt. Aufgrund dieser Annahme kann man schließen, dass die Behandlung mit Anti-mPD-L1 zu einem verzögerten Einsetzen der Metastasenbildung in Übereinstimmung mit der Verzögerung des primären Tumorwachstums führte. Es sollte beachtet werden, dass die Metastasenbildung in diesem Modell keine Verschlechterung der Gesundheit verursacht, da Mäuse die Studie aufgrund der Belastung durch den Primärtumor vor den gesundheitlichen Auswirkungen einer Metastasierung verlassen.
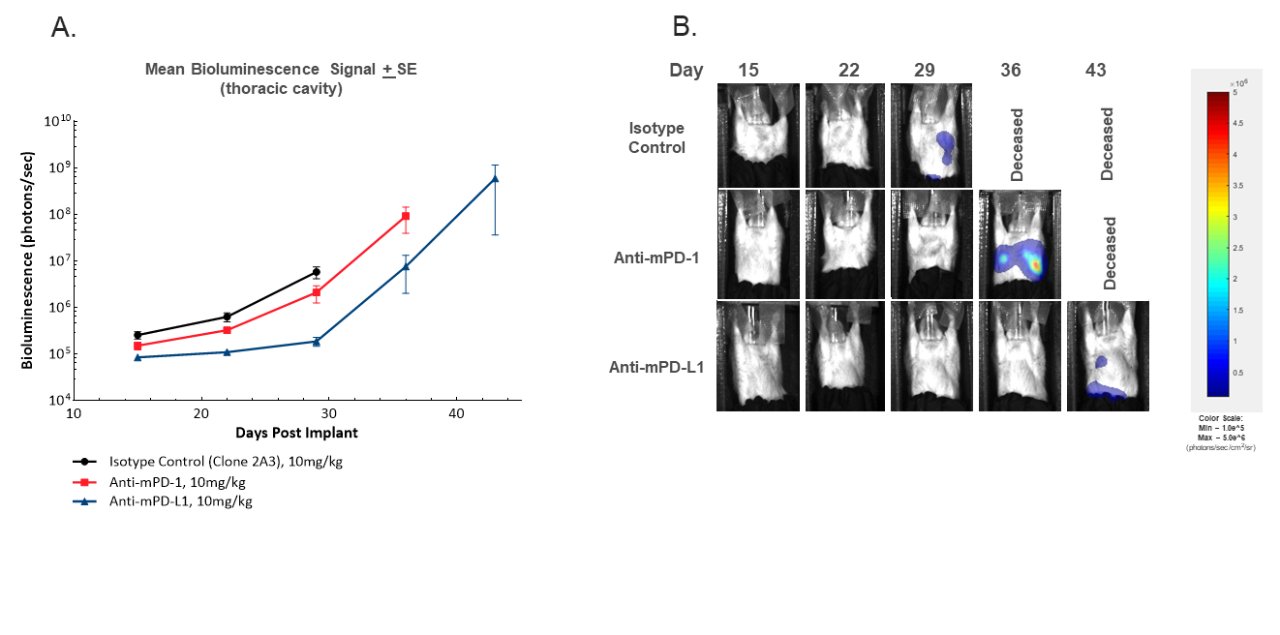
Abbildung 3. In-vivo-BLI-Bildgebung zur Überwachung der Entwicklung des Signals im Brustkorb im Laufe der Zeit anhand der mittleren Tumorlast im Brustbereich (A) oder repräsentativer BLI-Bilder (B).
Bei der Befragung von Modellen für immunonkologische Zwecke ist es auch wichtig, die Zusammensetzung der in einen Tumor eingeschleusten Immunzellen zu kennen. Hierzu wurden naive Tumoren zwischen 150 und 550 mm3 auf infiltrierte T-Zellen und myeloischen Zellen untersucht, ausgedrückt als Prozentsätze der gesamten CD45+-Zellen (Abbildung 4). Das myeloische Kompartiment war über sämtliche Tumoren gleichmäßig über M2-Makrophagen, monozytäre MDSC und granulozytäre MDSC verteilt. Das M1-Makrophageninfiltrat war vergleichsweise niedriger als bei anderen myeloiden Zellen und bei EMT6-Luc-Tumoren im Vergleich zu EMT6-Tumoren etwas höher. Das Infiltrat von CD4+- und CD8+-T-Zellen war sowohl in EMT6 als auch in EMT6-Luc-Tumoren minimal, aber dennoch konsistent, mit einer leichten Erhöhung der NK-Zellen in den EMT6-Luc-Tumoren. Diese Zusammensetzung deutet auf eine immunsuppressive Mikroumgebung hin, was die begrenzte Reaktion bei den meisten der getesteten Immuntherapieschemata erklären könnte.
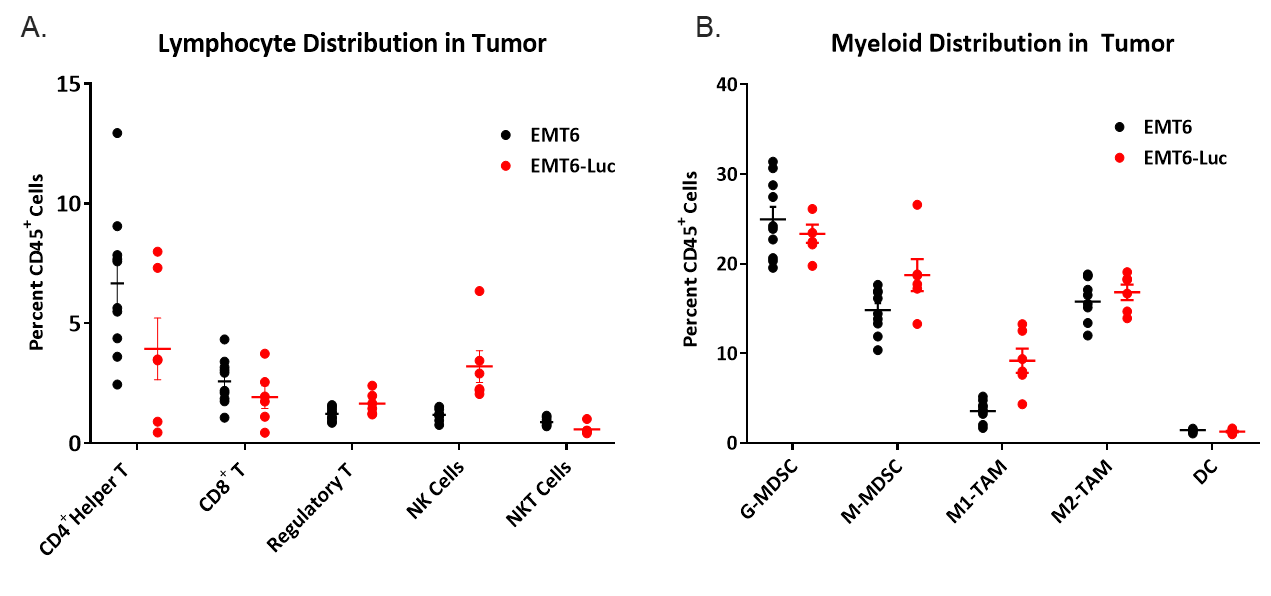
Abbildung 4. Verteilung der lymphoiden (A) und myeloischen (B) Immunzellen bei naiven EMT6- und EMT6-Luc-Tumoren.
Das EMT6-Luc-Brustkarzinommodell der Maus verfügt über ein günstiges Immunprofil, dass das gesamte Immunsystem der Maus nutzt und ein effektives Werkzeug im Bereich der Immunonkologie darstellt. Diese Daten unterstützen die Verwendung des EMT6-Luc-Modells als robustes präklinisches Modell in der Immunonkologie zur Beurteilung sowohl des primären Tumorwachstums als auch der Bildung entfernter Metastasen im Brustkorb.
Please contact us to speak with our scientists about how EMT6-Luc, or one of our other syngeneic models, can be used for your next immuno-oncology study.
Verweise
1 „American Cancer Society: Cancer Facts & Statistics.“ American Cancer Society | Cancer Facts & Statistics, cancerstatisticscenter.cancer.org/?_ga=2.5394928.293340281.1606765768–996476487.1605734560.
2 Howlader N, Noone AM, Krapcho M, Miller D, Brest A, Yu M, Ruhl J, Tatalovich Z, Mariotto A, Lewis DR, Chen HS, Feuer EJ, Cronin KA (Hrsg.). SEER Cancer Statistics Review, 1975–2017, National Cancer Institute. Bethesda, MD, https://seer.cancer.gov/csr/1975_2017/, based on November 2019 SEER data submission, posted to the SEER web site, April 2020.
3Leal JHS and McArthur H. Breast cancer immunotherapy: From biology to current clinical applications. Eur. Med. J., 2020; 5(2): 113-124.
4Rockwell SC, Kallman, RF, Fajardo, LF. Characteristics of a Serially Transplanted Mouse Mammary Tumor and Its Tissue-Culture-Adapted Derivative. J. Natl. Can. Inst., 1972; 49(3): 735–749.
Unterhalten wir uns
Kontakt