Date: May 2018
Brustkrebs ist die häufigste Krebsart bei Frauen in den USA und die vierthäufigste Krebstodesursache. Im Jahr 2017 wurden schätzungsweise 252.710 neue Fälle diagnostiziert (15 % aller neuen Krebsfälle) und 40.610 Patienten-Todesfälle traten auf. Früherkennungsinitiativen zusammen mit verbesserten Behandlungsmöglichkeiten haben zu einem Anstieg der 5-Jahres-Gesamtüberlebensrate von 75 % im Jahr 1975 auf über 90 % heute geführt.[1] Trotz der günstigen Überlebensstatistiken stellt die metastasierende Erkrankung nach wie vor eine Behandlungsherausforderung dar und führt häufig zum Tod. Aus diesem Grund ist die fortlaufende Entwicklung neuer Behandlungsmethoden für Brustkrebs notwendig.
Fortschritte beim Einsatz immunonkologischer Kombinationstherapien bei Brustkrebs
Während zur Bekämpfung von hormon- oder Her2-sensitiven Brustkrebserkrankungen mehrere Behandlungsoptionen zur Verfügung stehen, sind die Möglichkeiten für dreifach negative Brustkrebs-Patientinnen etwas eingeschränkt, die diese zielgerichteten Therapien nicht nutzen können. Hinzu kommt, dass sich Brustkrebs trotz der Erfolge mit Immuntherapien bei der Behandlung von Melanom- und Lungenkrebs als besonders schwierig durch Checkpoint-Blockade oder andere Immuntherapien zu behandeln erwiesen hat. However, with the focused effort in recent years towards immuno-oncology approaches to breast cancer, emerging clinical data is showing promise, particularly in combination therapy.[2] To help drive this research forward, we have developed the EMT-6 syngeneic breast tumor model. Abgeleitet von einem transplantierten hyperplastischen Alveolarknötchen in BALB/c-Mäusen[3] nutzt dieses Modell die Vorteile des kompletten Maus-Immunsystems und dient als leistungsfähiges Werkzeug im Bereich der Immunonkologie.
Prüfung von Kombinationstherapien mittels EMT-6-Modell
Brustkrebs ist die häufigste Krebsart bei Frauen in den USA und die vierthäufigste Krebstodesursache. Im Jahr 2017 wurden schätzungsweise 252.710 neue Fälle diagnostiziert (15 % aller neuen Krebsfälle) und 40.610 Patienten-Todesfälle traten auf. Früherkennungsinitiativen zusammen mit verbesserten Behandlungsmöglichkeiten haben zu einem Anstieg der 5-Jahres-Gesamtüberlebensrate von 75 % im Jahr 1975 auf über 90 % heute geführt.[1] Trotz der günstigen Überlebensstatistiken stellt die metastasierende Erkrankung nach wie vor eine Behandlungsherausforderung dar und führt häufig zum Tod. Aus diesem Grund ist die fortlaufende Entwicklung neuer Behandlungsmethoden für Brustkrebs notwendig.
Fortschritte beim Einsatz immunonkologischer Kombinationstherapien bei Brustkrebs
Während zur Bekämpfung von hormon- oder Her2-sensitiven Brustkrebserkrankungen mehrere Behandlungsoptionen zur Verfügung stehen, sind die Möglichkeiten für dreifach negative Brustkrebs-Patientinnen etwas eingeschränkt, die diese zielgerichteten Therapien nicht nutzen können. Hinzu kommt, dass sich Brustkrebs trotz der Erfolge mit Immuntherapien bei der Behandlung von Melanom- und Lungenkrebs als besonders schwierig durch Checkpoint-Blockade oder andere Immuntherapien zu behandeln erwiesen hat. However, with the focused effort in recent years towards immuno-oncology approaches to breast cancer, emerging clinical data is showing promise, particularly in combination therapy.[2] To help drive this research forward, we have developed the EMT-6 syngeneic breast tumor model. Abgeleitet von einem transplantierten hyperplastischen Alveolarknötchen in BALB/c-Mäusen[3] nutzt dieses Modell die Vorteile des kompletten Maus-Immunsystems und dient als leistungsfähiges Werkzeug im Bereich der Immunonkologie.
Prüfung von Kombinationstherapien mittels EMT-6-Modell
In diesem Modell-Spotlight präsentieren wir Daten aus unserer ersten Wirksamkeitsstudie mit dem EMT-6-Modell. Diese Daten sollten das Design rationaler Kombinationsstudien mit neuartigen Therapeutika ermöglichen, während zusätzliche Studien durchgeführt werden. Das Kontroll-Tumorwachstum für das EMT-6-Modell ist in Abbildung 1 dargestellt. Die mediane Verdopplungszeit beträgt durchschnittlich 5,5 Tage, wobei ein therapeutisches Fenster von wenigstens drei Wochen vorgesehen ist, um eine Antitumoraktivität auszulösen. Die Wachstumsraten von unbehandelten und mit einem Isotyp-Kontrollantikörper (Ratten-IgG2b) behandelten Tumoren sind nahezu überlagerbar. Um die Reaktion von EMT-6 auf immunmodulatorische Therapien zu bestimmen, wurden Mäuse mit EMT-6-Tumoren mit einer Checkpoint-Blockade (anti-mPD-1 und anti-mPD-L1) und anti-mCD137 behandelt, einem kostimulatorischen Molekül. Da zur Behandlung von Brustkrebs häufig fokale Bestrahlung eingesetzt wird, haben wir zusätzlich die Modellierung von Strahlenmonotherapie und Kombinationstherapie einbezogen.
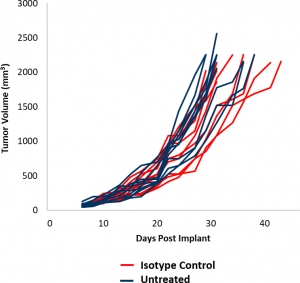
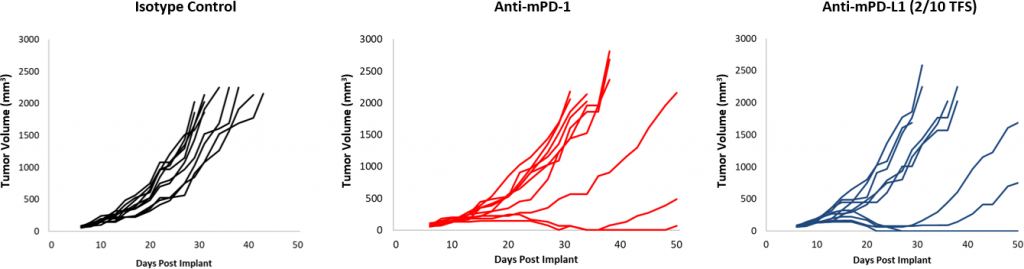
Abb. 2: EMT-6 Reaktion auf Checkpoint-Inhibitoren
Die Reaktionen auf die Checkpoint-Blockade waren im Vergleich zur Kontrolle insgesamt moderat (Abbildung 2). Obwohl eine Untergruppe von Tieren angesprochen hat, bietet die Behandlung mit anti-mPD-1 und anti-mPD-L1 in Kombination immer noch Möglichkeiten zur Verbesserungen. Des Weiteren bot eine Fokalbestrahlungs-Dosis von 10 Gy, die in anderen syngenen Modellen eine signifikante Verzögerung des Tumorwachstums verursacht, in der EMT-6 nur eine moderate Aktivität. Die Zugabe von anti-mPD-1 zu diesem Schema bietet eine gewisse additive Wirkung, jedoch gibt es in der Dreifachkombination immer noch Verbesserungsbedarf. Im Gegensatz dazu führt die Behandlung mit einer anti-mCD137-Monotherapie zu einer starken Reaktion (4/10 TFS) gegen EMT-6. Die Kombination mit fokaler Bestrahlung bot eine nominelle Verbesserung (5/10 TFS) gegenüber einer anti-mCD137-Monotherapie (Abbildung 3). Diese Daten zeigen den Vorteil der Verwendung des EMT-6-Modells zur Untersuchung von Doppel- oder Dreifach-Kombinationsstrategien, bei denen Strahlung, Checkpoint-Blockade und/oder kostimulatorische Molekül-Agonisten eingesetzt werden.
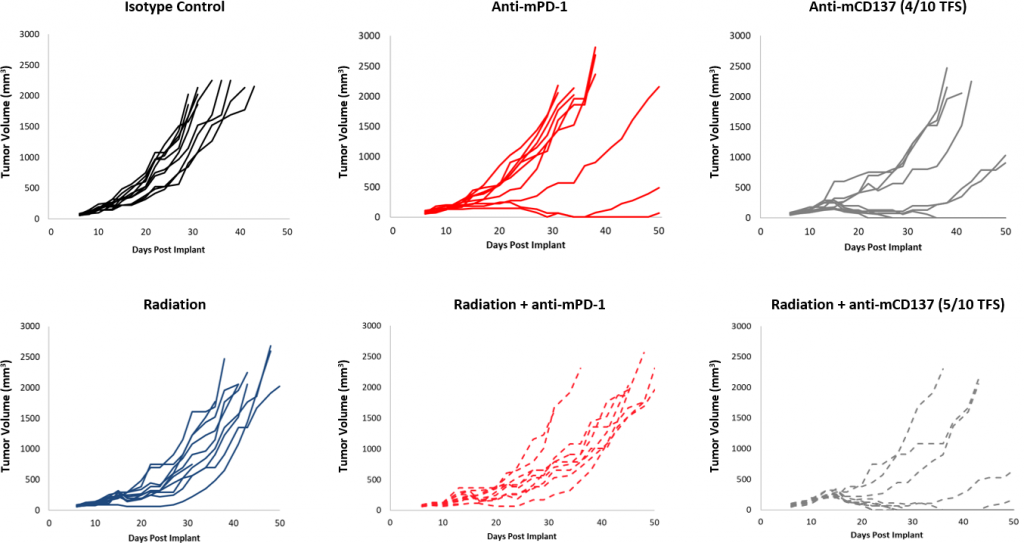
Abb. 3: EMT-6-Reaktion auf Kombinationstherapie mit fokaler Strahlung
Zusammensetzung infiltrierter Immunzellen innerhalb des Tumors
Bei der Befragung von Modellen für immunonkologische Zwecke ist es auch wichtig, die Zusammensetzung der in einen Tumor eingeschleusten Immunzellen zu kennen. Zu diesem Zweck wurden Tumoren zwischen 220 bis 385 mm3 auf infiltrierte T-Zellen und myeloische Zellen untersucht, ausgedrückt in Prozent der gesamten CD45+-Zellen (Abbildung 4). Das myeloische Kompartiment war über sämtliche Tumoren gleichmäßig über M2-Makrophagen, monozytäre MDSC und granulozytäre MDSC verteilt. Das M1-Makrophagen-Infiltrat war vergleichsweise niedriger als bei anderen myeloisch abgeleiteten Zellen. Diese Zusammensetzung deutet auf eine immunsuppressive Mikroumgebung hin, was die begrenzte Reaktion bei den meisten der getesteten Immuntherapieschemata erklären könnte.
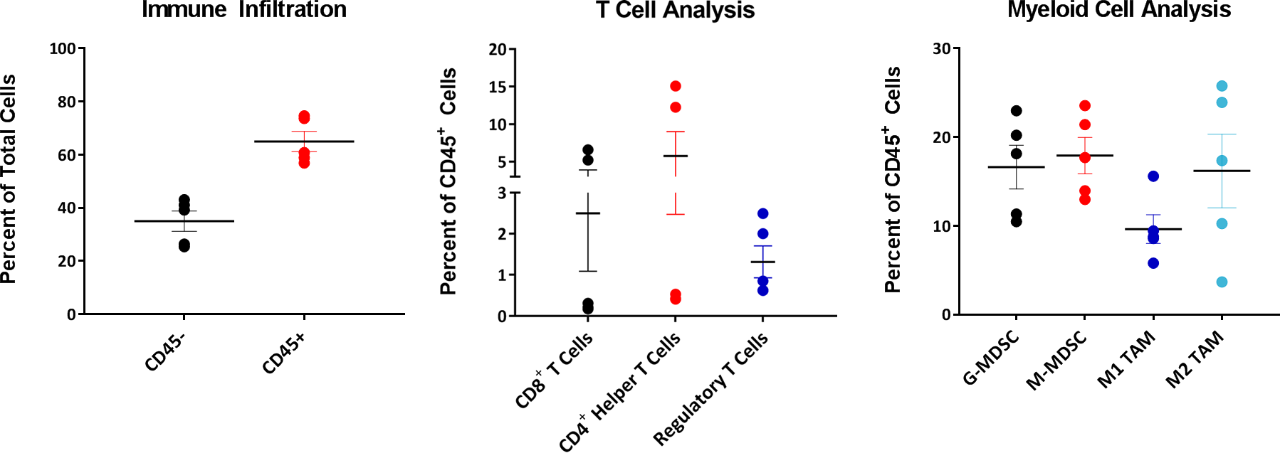
Abb. 4: EMT-6 Infiltrierte T-Zell- und myeloische Zellanalyse
Im Gegensatz dazu zeigte das T-Zellkompartiment Intertumorvariabilität, wobei drei von fünf Tumoren sehr niedrige Werte von CD4+- und CD8+-T-Zellen aufwiesen. Interessanterweise wies die Treg-Zusammensetzung in diesen Tumoren im Vergleich zu CD4+- und CD8+-T-Zell-Infiltraten eine viel geringere Variabilität zwischen den Tumoren auf. Derzeit laufen Studien, um festzustellen, ob die Variabilität, die bei infiltrierten CD4+- und CD8+-T-Zellen bei diesen EMT-6-Tumoren beobachtet wurde, mit der Biologie dieses Modells zusammenhängt oder ob sich die Variabilität bei einer größeren Stichprobengröße normalisieren würde.
EMT-6 – Ein robustes präklinisches Immunonkologie-Modell
Das EMT-6-Modell des syngenen Mammakarzinoms weist ein günstiges Immunprofil auf und kann als robustes präklinisches immunonkologisches Modell eingesetzt werden. Unsere Daten unterstützen die Verwendung dieses Werkzeugs bei der Untersuchung neuartiger Behandlungskombinationen mit Bestrahlung, Checkpoint-Inhibitoren oder kostimulatorischen Molekülen.
MODEL SPOTLIGHT | EMT-6 Syngeneic Breast Tumor Model – A Powerful Tool for Immuno-Oncology Studies (PDF Version)
Verweise
Unterhalten wir uns
Kontakt