Author: Mark J Cameron, Director of Scientific Development
Date: November 2020
In der präklinischen Forschung und Entwicklung werden CAR-T-Zelltherapien (chimärer Antigenrezeptor) häufig unter Verwendung einer Maus als Testsubjekt untersucht. In diesem Umfeld tragen immungeschwächte Mäuse eine Tumorlast menschlichen Ursprungs und werden mit allogenen menschlichen CAR-T-Zellen dosiert. Durch den erzeugten chimären Antigenrezeptor binden sich die adoptiv übertragenen Zellen an ein Oberflächenantigen auf einer Tumorzelle (z. B. CD19).
Infolge der erzeugten T-Zell-Bindung an die Tumorzelle wird die T-Zelle aktiviert und tötet Tumorzellen in einem MHC uneingeschränkt ab. Mice in preclinical research studies are followed for a number of predefined parameters, evaluating tumor growth and burden to determine the efficacy of the CAR T cells (Learn more about how efficacy can be determined by bioluminescence imaging (BLI).
Ein wesentlicher Erfolgsfaktor der CAR-T-Zell-Antitumorantwort ist, wie lange die CAR-T-Zellen nach der Infusion in den Wirt existieren (Persistenz). Despite full functionality, it has been shown that poor persistence of CAR T cells can limit an effective antitumor response.1 In the clinical setting, long-term remission in patients with hematological malignancies is associated with sustained persistence of CAR T cells.2 Co-stimulatory signaling is thought to influence T cell expansion and persistence. Preclinical studies investigating the efficacy of CAR constructs that are engineered to include the 4-1BB co-stimulator domain have been associated with long CAR T cell persistence, a slower and sustained effector function, and a higher proportion of memory T cells.3 Assessing CAR T persistence in preclinical studies have implications in determining clinical success.
Dieses Technologie-Spotlight bietet dem Leser Informationen zur Messung der Persistenz von CAR-T-Zellen mithilfe der Durchflusszytometrie während der präklinischen Phase.
Mausmodelle für die Bewertung von CAR-T-Zellkandidaten
Im September 2017 genehmigte die Food and Drug Administration die erste CAR-T-Zelltherapie. Die Zelltherapie wird von Novartis vermarktet und heißt Kymriah. Kymriah ist auch als Tisagenlecleucel bekannt und wurde für Kinder und junge Erwachsene zugelassen, die nicht länger auf Standardtherapien für akute lymphatische B-Zell-Leukämie ansprechen. Kymriah basiert auf der Arbeit von Carl June, PhD., an der University of Pennsylvania, in NSGTM-Mäusen.
Die NOD.Cg-Prkdcscid-Il2rgtm1Wjl/SzJ-Maus, allgemein bekannt unter dem Markennamen NOD scid gamma (NSG™), exprimiert weder das Prkdc-Gen noch das X-verbundene Il2rg-Gen. Die scid-Mutation (schwerer kombinierter Immundefekt) befindet sich im DNA-Reparaturkomplexprotein Prkdc und führt zu einem Mangel an B- und T-Zellen der Mäuse. Diese Mäuse haben weder komplementäre noch natürliche Killerzellen (NK) und weisen einen Mangel an Zytokin-Signalwegen auf. Diese Mängel machen die Mäuse für die Transplantation menschlicher Immunzellen, einschließlich CAR-T-Zellen, ideal und sehr empfänglich. Die Mäuse transplantieren eine Vielzahl menschlicher Tumore und sind der Standard für die präklinische CAR-T-Zellforschung.
In unserer Abteilung für präklinische Onkologie können wir jeden im Handel erhältlichen Mausstamm für die CAR-T-Zelltherapie und andere adoptive Zelltransferstudien verwenden, einschließlich NSGNSGTM-Mäuse, und unter bestimmten Bedingungen können wir auch spezielle Mäuse akzeptieren.
Das PersistenceTTM Panel von des Bereichs Präklinische Onkologie bei Covance wird verwendet, um longitudinale CAR-T-Zell-Persistenzdaten zu erzeugen, die mit nur 5 ul Vollblut verwendet werden können. Es ist als Lyse-ohne-Waschung-Assay mit absoluten Zählwerten formatiert. Das Panel ist flexibel und bietet die Möglichkeit, spezifische Anti-CAR-Sonden in den FITC-, PE- und APC-Kanälen hinzuzufügen. NSG-Mäusen aus dem Jackson Labor (Bar Harbor, Maine, USA) wurden 2x107 menschliche PBMC verabreicht, Vollblut wurde 7, 14 und 21 Tage nach der Verabreichung entnommen und im PersistenceTTM Panel untersucht.
Tabelle 1 beschreibt die Reagenzien, die im PersistenceTTM Panel verwendet werden. Die Gating-Strategie ist in Abbildung 1 detailliert dargestellt.
Antikörper / Farbstoff |
Beschreibung |
|---|---|
mCD45 |
Panhämatopoetische Zellen der Maus |
hCD45 |
Menschliche panhämatopoetische Zellen |
hCD3 |
Menschlicher Pan-T-Zell-Marker |
hCD4 |
Menschlicher CD4+-T-Zell-Marker |
hCD8 |
Menschlicher CD8+-T-Zell-Marker |
Bead-Zählung |
Liefert absolute Zählwerte |
Vitalitätsfarbstoff |
Ausschluss toter Zellen |
Optional: CAR-spezifisch |
FITC, PE oder APC |
Tabelle 1: PersistenceTTM Panel von Antikörpern und Beschreibung ihrer Verwendung.
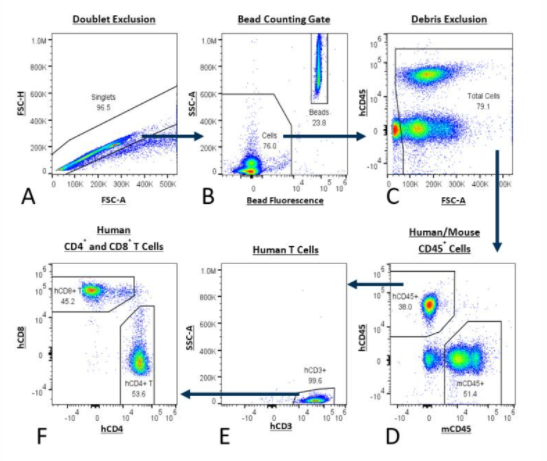
Abbildung 1: Analyse menschlicher T-Zellen mit dem PersistenceTTM Panel. Die Gating-Strategie beginnt mit dem doppelten Ausschluss (A) und kombiniert Bead-Fluoreszenz mit einem Bead-Zähl-Gate (B). Als Nächstes werden Überbleibsel ausgeschlossen (C) und Mauszellen werden von menschlichen Zellen unterschieden, unter Verwendung von Anti-Maus-CD45 mit Anti-Human-CD 45 (D). Menschliche T-Zellen werden durch Anti-Human-CD3-Gating (E) isoliert und abschließend wird die Anzahl menschlicher CD8+- und CD4+-T-Zellen bestimmt (F).
Immunphänotypische Längsschnittcharakterisierung von CAR-T-Zellen unter Verwendung des PersistenceTTM Panel
Im klinischen Onkologieumfeld korrelieren die CAR-T-Zellen-Expansion und -Persistenz mit dem Ansprechen und dem Erreichen einer Remission bei Patienten.4 Aufgrund dieser Beobachtung ist es besonders wichtig, zuverlässige Methoden zur Verfolgung der CAR-T-Zellzahlen zu etablieren, nicht nur bei der Abschätzung der Wirksamkeit der CAR-T-Zelltherapie, sondern auch bei der Sicherheitsbewertung im präklinischen Umfeld. Serious side effects of clinical CAR T cell therapy are noted, one of the most severe being cytokine release syndrome (CRS) and is associated with CAR T cell expansion in vivo.5
The PersistenceTTM Panel is directly applicable to the evaluation of human CAR T cell numbers in samples taken from mice over time. Aufgrund des geringen Vollblutbedarfs können Proben mehrmals von derselben Maus oder unter Verwendung von Mäusekohorten zur Erreichung der Studienziele entnommen werden. NSG-Mäuse können Langzeitstudien zur gezielten Beurteilung der CAR-T-Persistenz unterzogen werden. Ein Beispiel dafür, wie das PersistenceTTM Panel verwendet werden kann, um menschliche T-Zellen in NSG-Mäusen im Laufe der Zeit zu messen, ist in Abbildung 2 dargestellt.
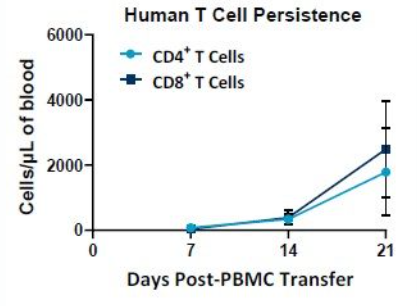
Verbesserung der CAR-T-Zell-Persistenz
In-vivo-CAR-T-Zellen-Persistenz ist ein Surrogatmarker für die langfristige klinische Wirksamkeit der CAR-T-Zelltherapie. Studien haben gezeigt, dass bestimmte CAR-T-Zellen, die eine kostimulatorische CD28-Domäne enthalten, eine erhöhte Expression von T-Zell-Erschöpfungs-verwandten Genen zeigen, während die 4-1BB (TNFSF9) kostimulatorische Domäne mit der gleichen Antigenspezifität den Erschöpfungs-Phänotyp reduzierte. Dies könnte erklären, warum in klinischen Studien mit Patienten mit rezidivierter oder refraktärer akuter lymphoblastischer Leukämie berichtet wurde, dass CAR-T-Zellen, die eine CD28-Domäne exprimieren, bis zu 3 Monate bestehen bleiben, während CAR-T-Zellen mit einer 4-1BB-Domäne bis zu 5 Jahre und in fast allen Fällen, die ausgewertet werden konnten, länger als 6 Monate bestehen bleiben.6
CAR-T-Zellen über die Generationen hinweg
CAR-T-Zellen entwickeln sich durch Modifikation des chimären Antigenrezeptors weiter. Jede CAR-T-Zelle hat ein scFv (Single-Chain Fragment Variable, variables Einzelketten-Fragment). Das scFv ist eine Kombination aus der variablen Region der Schwerketten-Domänen (VH) und der variablen Region der Leichtketten-Domänen (VL). Ein scFv ist ein Fusionsprotein aus schweren Ketten und leichten Ketten von Immunglobulinen, das mit einem kurzen Linkerpeptid zwischen 10 und 25 Aminosäuren verbunden ist.
CAR der ersten Generation haben eine extrazelluläre Bindungsdomäne, eine Verbindungsregion, eine Transmembrandomäne und eine oder mehrere intrazelluläre Signaldomänen. Alle CAR-T-Zellen haben die CD3-ζ-Kettendomäne für die intrazelluläre Signalübertragung und sind der primäre Übermittler von T-Zell-Aktivierungssignalen. CAR der zweiten Generation sind durch das Hinzufügen einer kostimulierenden Domäne (CD28 oder 4-1BB) definiert. Das Ziel war es, die T-Zell-Proliferation, die Zytokinsekretion und die In-vivo-Persistenz zu verbessern.
Präklinische Daten zeigen, dass CAR der dritten Generation im Gegensatz zu CAR der zweiten Generation eine verbesserte Effektorfunktion und eine längere In-vivo-Persistenz aufweisen. CAR der dritten Generation haben mehrere kostimulierende Domänen (CD28-41BB oder CD28-OX40). „Armored CAR“ und „TRUCKs“ (CAR-T-Zellen, die zur allgemeinen Zytokin-Tötung umgeleitet wurden) sind Namen, die manchmal für die CAR-T-Zellen der vierten Generation verwendet werden. CAR-T-Zellen der vierten Generation können Faktoren enthalten, die die T-Zell-Expansion, Antitumoraktivität und Persistenz verbessern.7
Unabhängig von der CAR- oder TRUCK-Generation bietet das PersistenceTTM Panel ein hervorragendes Instrument zur kurz- oder langfristigen Überwachung der In-vivo-CAR-T-Zell-Persistenz im präklinischen Umfeld.
Zusammenfassung
Die Messung der CAR-T-Persistenz wird mit dem PersistenceTTM Panel einfach gemacht. Unser Durchflusszytometrie-Panel ermöglicht die Bestimmung der longitudinalen CAR-T-Persistenz aus einem kleinen Blutvolumen. Unser menschliches CompTTM Panel (Tabelle 2) ist ein hervorragendes Beispiel dafür, wie andere qualifizierte Panels zu einer präklinischen CAR-T-Studie hinzugefügt werden können, um umfassende Durchflusszytometrie-Datensätze zu generieren.
Antikörper / Farbstoff |
Beschreibung |
|---|---|
hCD45 |
Menschliche panhämatopoetische Zellen |
hCD3 |
Menschlicher Pan-T-Zell-Marker |
hCD4 |
Menschlicher CD4+-T-Zell-Marker |
hCD8 |
Menschlicher CD8+-T-Zell-Marker |
hCD25 |
Menschlicher regulatorischer T-Zell-Marker |
hFoxP3 |
Menschlicher regulatorischer T-Zell-Marker |
hPD-1 |
Menschliches T-Zell-inhibitorisches Signalprotein |
hCD69 |
Aktivierungsmarker |
Ki-67 |
Proliferationsmarker |
Vitalitätsfarbstoff |
Ausschluss toter Zellen |
Tabelle 2. Individuelle Marker im menschlichen CompTTM-Leukozyten-Panel.
To learn more about how the PersistenceTTM Panel, or one of our other flow cytometry panels, can be incorporated into your preclinical oncology research and to learn more about our extensive flow cytometry program contact the scientists.
Verweise
1Song DG, Ye Q, Carpenito C, Poussin M, Wang LP, Ji C, Figini M, June CH, Coukos G, Powell DJ Jr. In vivo persistence, tumor localization, and antitumor activity of CAR-engineered T cells is enhanced by costimulatory signaling through CD137 (4-1BB).
Cancer Res. 2011 Jul 1;71(13):4617–27.
2Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. N Engl J Med. 2014;371(16):1507–17.
3Long AH, Haso WM, Shern JF, Wanhainen KM, Murgai M, Ingaramo M, et al. 4-1BB costimulation ameliorates T cell exhaustion induced by tonic signaling of chimeric antigen receptors. Nat Med. 2015;21:581–90.
4Porter DL, Hwang WT, Frey NV, Lacey SF, Shaw PA, Loren AW, et al. Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia. Sci Transl Med. 2015;7(303):303ra139.
5Santomasso B, Bachier C, Westin J, Rezvani K, Shpall EJ. The Other Side of CAR T-Cell Therapy: Cytokine Release Syndrome, Neurologic Toxicity, and Financial Burden.
Am Soc Clin Oncol Educ Book. 2019 Jan;39:433–444.
6Maus MV and June CH. Making Better Chimeric Antigen Receptors for Adoptive T-cell Therapy. Clin Cancer Res. 2016 Apr 15; 22(8): 1875–1884.
7Chmielewski M, Abken H. TRUCKs: the fourth generation of CARs. Expert Opin Biol Ther. 2015;15(8):1145–54.
Unterhalten wir uns
Kontakt