Date: December 2020
Das Aufkommen von Therapien, die die inhärente Antitumoraktivität des Immunsystems gegen Krebs nutzen, stellt einen Paradigmenwechsel in der Onkologietherapie dar, der die Zukunft der Krebsbekämpfung nachhaltig verändert hat.
Darmkrebs (CRC) trägt maßgeblich zu den allgemeinen Krebserkrankungen bei und macht 10 % aller Krebsfälle aus. Im Jahr 2018 wurden weltweit über eine Million neue Fälle von Darmkrebs beobachtet, welche zu über einer halben Million Todesfälle führten1. Klinische Behandlungen umfassen eine chirurgische Resektion, gefolgt von einer adjuvanten Chemotherapie bei nicht metastasiertem Darmkrebs mit gezielteren Therapien bei metastasiertem Darmkrebs2. Jüngste klinische Studien zeigen starke Ergebnisse für die Immun-Checkpoint-Hemmung bei der Behandlung von Patienten mit nicht resezierbarem, metastasierendem Darmkrebs mit hoher Mikrosatelliteninstabilität (MSI-H) oder Fehlpaarungsreparatur (dMMR)3. Der klinische Nutzen war so groß, dass Keytruda (monoklonaler Antikörper gegen das humane PD-1-Immun-Checkpoint-Protein) im Sommer 2020 als Erstlinientherapie für Darmkrebs-Patienten zugelassen wurde, die diese drei Kriterien erfüllen4. Mit diesem neuen Versprechen der Immuntherapie gegen Darmkrebs sind hoch translationale präklinische Modelle der Krankheit erforderlich, um die Wirksamkeit neuartiger immunonkologischer Wirkstoffe zu bewerten.
Die Beurteilung der Wirksamkeit von Therapeutika, die auf das Immunsystem abzielen, erfordert präklinische Tumormodelle mit intaktem Immunsystem zur Manipulation durch Testmittel. Syngene Tumormodelle stellen eine solche Strategie dar, bei der von Mäusen stammende Krebszellen gezüchtet werden, um einen Tumor im immunkompetenten Mausstamm des Tumorzellursprungs zu bilden. We have extensively used CT26.WT murine colon carcinoma as a subcutaneous tumor model in female Balb/c mice to evaluate the efficacy of immuno-oncology agents - see our previous work in the model spotlights below (additional data available upon request):
- Spotlight: CT26-Kolonkarzinom der Maus
- Poster: Charakterisierung der Proliferation in multiplen Lymphozyten-Untergruppen im CT26-Kolonkarzinom-Modell der Maus durch Mehrfarben-Durchflusszytometrie
- Poster: Immunphänotypische und Transkriptomanalysen von CT26- und 4T1Luc-Tumormodellen nach Anti-CTLA-4-Behandlung
Wir wissen um die experimentellen und translationalen Grenzen subkutaner Tumormodelle, die im Vergleich zu Tumoren, die aus dem Ursprungsorgan entspringen, eine andere Mikroumgebung des Tumors aufweisen, einschließlich, aber nicht beschränkt auf unterschiedliche Immunzellprofile, die die Reaktion auf eine Immuntherapie beeinflussen können5,6. Das Implantat von Tumorzellen in das Ursprungsgewebe, auch bekannt als orthotopes Tumorimplantat, versucht, die Einschränkungen subkutaner Studien zu korrigieren und die potenzielle Übertragbarkeit des Modells zu erhöhen.
In diesem Modell-Spotlight werden Daten bereitgestellt, die ein robustes und reproduzierbares orthotopes Tumormodell der Maus unter Verwendung des CT26.WT-Kolonkarzinoms und zuverlässige chirurgische Methoden zur Implantation und Validierung der Reaktion auf Checkpoint-Hemmung demonstrieren.
Alle Arbeiten mit Tieren wurden vom Institutional Animal Care and Use Committee des Standorts genehmigt und in Übereinstimmung mit dem Handbuch für die Pflege und Nutzung von Labortieren im Rahmen eines AAALAC-akkreditierten Programms sowie mit im Vorfeld festgelegten humanen Euthanasiekriterien für alle Studien durchgeführt.
Orthotopes Wachstum von CT26.WT-luc-Tumoren
Abbildung 1. Wachstumskinetik der von CT26.WT-luc abgeleiteten Tumore, die orthotop in Balb/c-Mäuse implantiert wurden
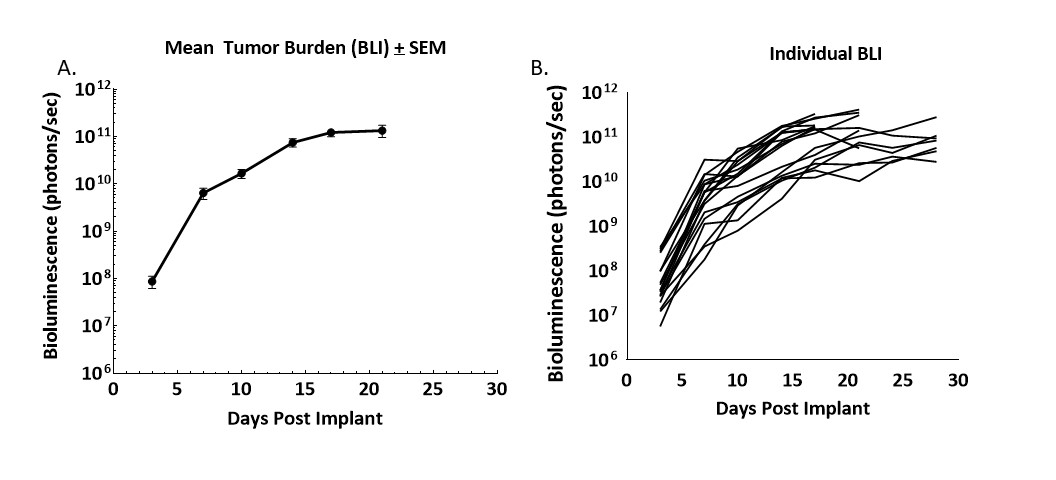
Abbildung 1 – Längsschnittüberwachung der Tumorlast nach dem orthotopen Implantat von CT26.WT-luc-Tumorfragmenten durch Biolumineszenz-Bildgebung bei 20 Balb/c-Mäusen. Die Biolumineszenz wurde drei Tage nach der Implantation eingeleitet, wobei der Gruppenmittelwert (A) und die Einzelwerte (B) angegeben sind.
Das Fortschreiten der Tumorlast war robust und minimal variabel. Die Tumor-Transplantationsrate betrug 95 %, basierend auf BLI und Autopsie, und es wurden keine spontanen Regressionen beobachtet. Die vom BLI abgeleitete Verdopplungszeit des Tumorvolumens (Td) betrug 1,5 Tage und die mittlere Studienzeit betrug 21 Tage.
Häufige klinische Beobachtungen im Zusammenhang mit dem Fortschreiten der Krankheit waren eine abdominale Ausdehnung aufgrund von Tumorwachstum und Körpergewichtszunahme (Daten nicht gezeigt). Die Autopsie ergab große Primärmassen am Blinddarm und kleine Knoten an der Leber und Bauchdecke. Es wurde beobachtet, dass Primärtumore am Darm eine große Gefäßintegration mit diesem aufweisen, was auf eine effiziente Gefäßrekrutierung durch den Tumor hinweist. Unser nächster Ansatz bestand darin, dieses Modell zur Bestimmung der Wirksamkeit von immunonkologischen Wirkstoffen zu verwenden.
Checkpoint-Hemmung im orthotopen CT26.WT-luc-Tumormodell
Naive Balb/c-Mäuse wurden einem chirurgischen Implantat von CT26.WT-luc-Tumorfragmenten unterzogen, wie zuvor beschrieben. Die Tiere wurden drei Tage nach der Operation durch BLI inszeniert und basierend auf den BLI-Werten in Behandlungsgruppen aufgeteilt. Animals were treated by intraperitoneal administration of 10mg/kg isotype control (clone LTF-2), anti-mPD-L1 (clone 10F.9G2), anti-mCTLA-4 (clone 9D9) or anti-mPD-1 (clone RMP1-14) twice weekly for two weeks. Alle Antikörper stammen von BioXCell (Lebanon, New Hampshire, USA). Die Tiere wurden durch zweimal wöchentliche BLI-Messungen auf Tumorlast, dreimal wöchentliche Messung des Körpergewichts, tägliche klinische Beobachtungen und Beobachtungen der Autopsie überwacht.
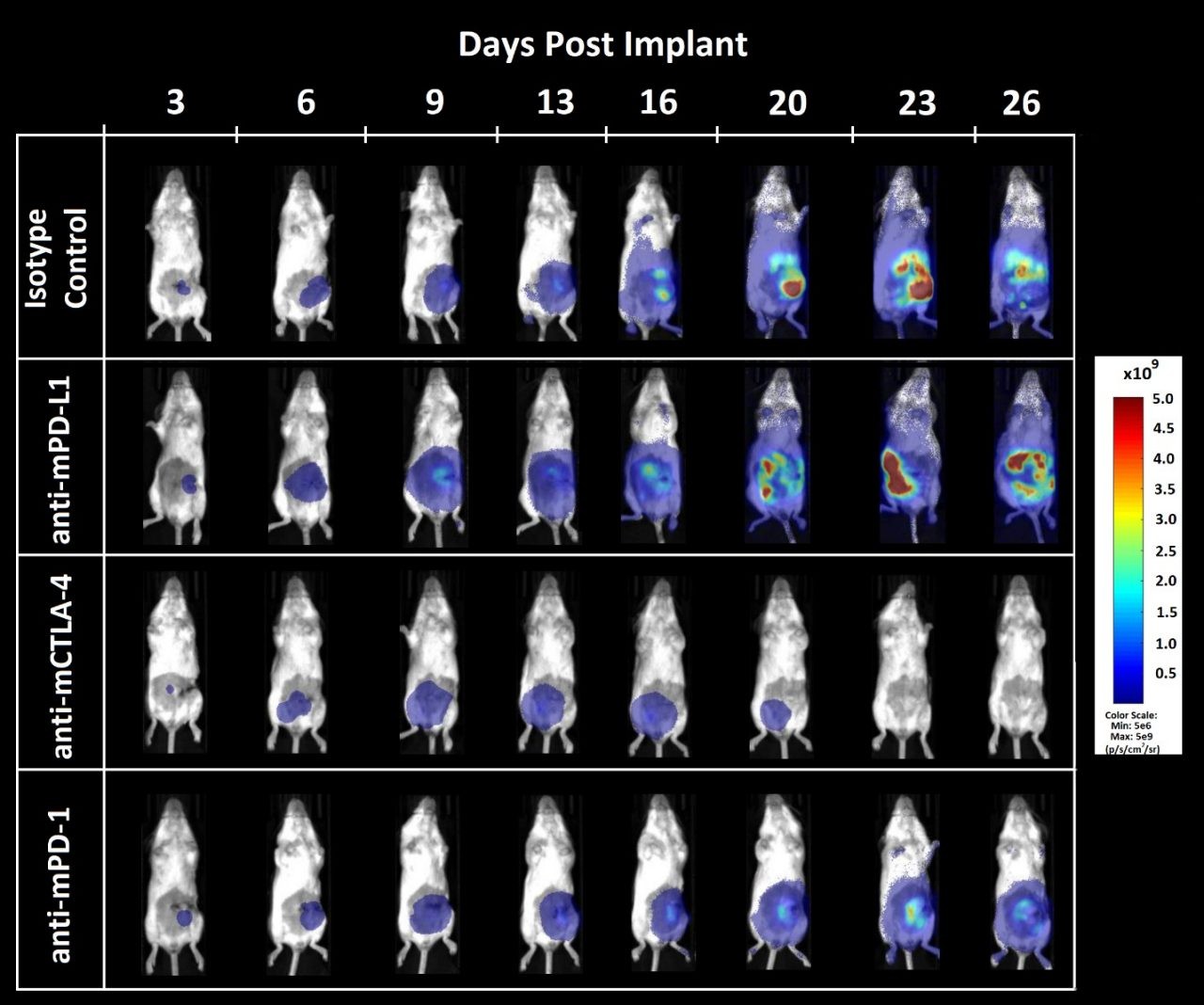
Abbildung 2 – Reaktion von orthotop implantierten CT26.WT-luc-Tumoren auf Checkpoint-blockierende Antikörper. Mittlere Tumorlast der Gruppe, bewertet durch BLI (A) und einzelne Tier-BLI-Werte (B–E) als Reaktion auf die angegebenen Therapien.
Die Verabreichung des Isotyp-Kontrollantikörpers hatte keinen Einfluss auf die Tumorlast oder das Fortschreiten der Krankheit (Abbildung 2A, 2B). Die Tumorverdopplungszeit der Tiere, denen die Isotypkontrolle verabreicht wurde, betrug 2,2 Tage, und die mittlere Studienzeit betrug 28 Tage. Die Verabreichung von Anti-mPD-L1 (Abbildung 2A, 2C) führte zu einer vollständigen Regression (keine nachweisbare Tumorlast über den ursprünglichen BLI-Werten). Anti-mCTLA-4-Behandlung (Abbildung 2A, 2D) führte zu einem ΔT/ΔC von 0,1 % an Tag 23 und fünf partielle Regressionen (BLI-Wert weniger als die Hälfte des ersten Behandlungstages) ohne sichtbar nachweisbare Erkrankung bei der Autopsie. Die Verabreichung von Anti-mPD-1 (Abbildung 2A, 2E) führte nicht zu Regressionen oder tumorfreien Überlebenden.
Abbildung 3. Biolumineszenz-Bildgebung der orthotopen CT26.WT-luc-Tumorantwort auf Checkpoint-Hemmung
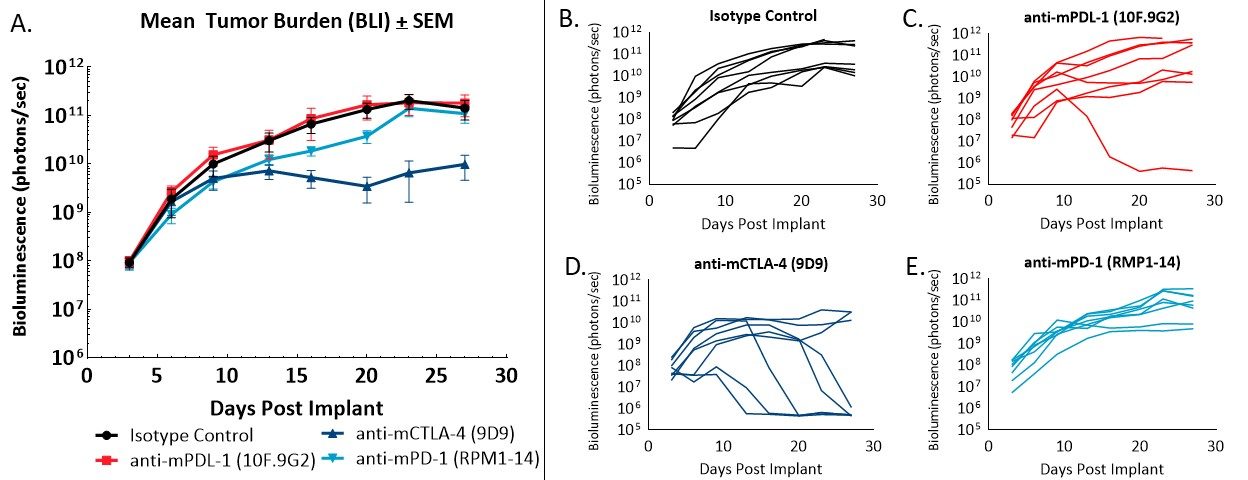
Abbildung 3 – Biolumineszenz-Bildgebung bei von CT26.WT-luc abgeleiteten Tumoren, die orthotop in weibliche Balb/c-Mäuse implantiert wurden, die mit einer Immun-Checkpoint-Blockade behandelt wurden. Die präsentierten Tiere sind repräsentativ für den mittleren BLI-Wert für die jeweilige Gruppe.
Die Tumorlast war im Bauchraum lokalisiert und nahm im Laufe der Zeit zu (Abbildung 3), wie aufgrund früherer Pilotwachstumsexperimente erwartet (Daten nicht gezeigt). Die Behandlung mit Anti-mCTLA-4 führte zu einem verzögerten Einsetzen der krankheitsbedingten Körpergewichtszunahme (Daten nicht gezeigt). Die Verabreichung von Anti-mPD-L1 bzw. Anti-mCTLA-4 führte zu einer Erhöhung des Lebensdauervorteils gegenüber der Isotypkontrolle von 12,5 bzw. 23,6 Tagen. Die Autopsie ergab keine Hinweise auf Tumore oder andere Läsionen bei 1 von 8 Tieren, denen Anti-mPD-L1 verabreicht wurde, und bei 5 von 8 Tieren, denen Anti-mCTLA-4 verabreicht wurde.
In der laufenden Arbeit werden die Unterschiede zwischen subkutaner und orthotoper CT26.WT-Implantatlage in Bezug auf das Infiltrat von Tumorimmunzellen, histologische Eigenschaften und Morphologie sowie die immunologische Aktivierung als Reaktion auf eine Checkpoint-Blockade untersucht.
In der Summe haben wir gezeigt, dass das orthotope CT26.WT-luc-Modell von Darmkrebs eine robuste Plattform für die Bewertung von immunonkologischen Wirkstoffen an einer hoch translationalen Implantatstelle bietet.
Contact our scientists to learn more about the CT26.WT-luc, and other murine orthotopic tumor models, and how we can apply these tools to advance your oncology pipeline.
Verweise
1Bray F, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68:6, 394–424.
2Kuipers E, et al. Colorectal Cancer. Nat Rev Dis Primers. 2015; 1: 15065.
3Tintelnot J, Stein A. Immunotherapy in colorectal cancer: available clinical evidence, challenges and novel approaches. World J Gastroenterol. 2019; 25:29, 3920–3928.
4Food and Drug Administration. Die FDA genehmigt eine Erstlinien-Immuntherapie für Patienten mit metastasiertem MSI-H-/dMMR-Darmkrebs. Pressemitteilung, 29. Juni 2020.
5Devaud C, et al. Tissues in different anatomical sites can sculpt and vary the tumor microenvironment to affect responses to therapy. Mol Ther. 2014; 22:1, 18–27.
6Zhao X, Li L, Starr TK, Subramanian S. Tumor location impacts immune response in mouse models of colon cancer. Oncotarget 2017; 8:33, 54775–54787.
7Fiegle E, Doleschel D, et al. Dual CTLA-4 and PDL-1 blockade inhibits tumor growth and liver metastasis in a highly aggressive orthotopic mouse model of colon cancer. Neoplasia 2019; 21:9, 932-944
Unterhalten wir uns
Kontakt