Autor: Sumithra Urs, PhD | Wissenschaftlerin, Wissenschaftliche Entwicklung
Date: January 2019
Die akute myeloische Leukämie (AML) ist die häufigste hämatologische Malignität bei Erwachsenen mit einer 5-Jahres-Überlebensrate von ~25 % nach der Diagnose.[1] Während zwei Drittel der mit einer Standard-Hochdosis-Chemotherapie behandelten AML-Patienten eine Remission erreichen, erleiden 50 % der Patienten nach der Remission einen Rückfall. Die Mehrzahl der Rückfälle tritt innerhalb von zwei bis drei Jahren nach der Erstbehandlung auf, und jeder Patient trägt aufgrund der molekularen Heterogenität der Erkrankung das Risiko eines Rückfalls. Dies hat den Anstoß gegeben, neue therapeutische Ansätze zu erkunden; insbesondere immunbasierte Therapien, da AML-Zellen sowohl die Haupthistokompatibilitätskomplex-(MHC)-Klassen I als auch II exprimieren, was sie zu empfänglichen Zielen angeborener und adaptiver Immunantworten macht.[3]
In unserem Modell-Spotlight vom April 2017 präsentierten wir Daten zur präklinischen Modellentwicklung des C1498-Luc-mCherry-Modells der systemischen akuten myeloischen Leukämie bei C57BL/6-Mäusen. Die Linie ist als disseminiertes Modell hochaggressiv, mit einer medianen Tumorverdopplungszeit von 1,3 Tagen basierend auf der Biolumineszenz-Bildgebung (BLI) und einem medianen Gesamtüberleben von ~23 Tagen. In fortgesetzten Bemühungen, das Modell für immunonkologische Anwendungen zu erweitern, präsentieren wir hier Daten zur Reaktion auf Immunkontrollpunkt-Blockade.
C1498-Luc-m-Cherry-Tumorzellverteilung
Nach der IV-Implantation von Zellen stellen wir fest, dass sich solide Tumormassen in einer Reihe von Geweben entwickeln, darunter in den Eierstöcken, der Leber und der Wirbelsäule. Um die Verteilung der C1498-Luc-mCherry-Tumorzellen im Modell zu verstehen, wurde eine Durchflusszytometrie an Milz, Knochenmark und Tumoren auf den/um die Eierstöcke durchgeführt. Die Proben wurden von fünf C57BL/6-Mäusen 21 Tage nach der Implantation von C1498-Luc-mCherry entnommen. Da es sich bei der Linie um eine myeloische Malignität handelt, ist es nicht überraschend, dass 97 % der analysierten Zellen CD45+ in den Tumoren um das Ovar herum waren. Wir stellten bei der Untersuchung von mCherry fest, dass nur sehr wenige Tumorzellen in der Milz (~2 %) und im Knochenmark (6 %) vorhanden waren, während fast 78 % der CD45+-Zellen in den Ovarialtumoren mCherry+ waren (Abb. 1A). Die histopathologische Evaluierung von H&E-gefärbten Schnitten ovarialbasierter Tumoren bestätigte das Vorhandensein homogener Populationen neoplastischer Zellen mit ähnlicher Morphologie. Die Tumormassen setzten sich aus mäßig pleomorphen Tumorzellen mit runden bis länglichen Kernen und spärlichem Zytoplasma mit einer hohen Anzahl mitotischer Figuren zusammen (Abb. 1B).
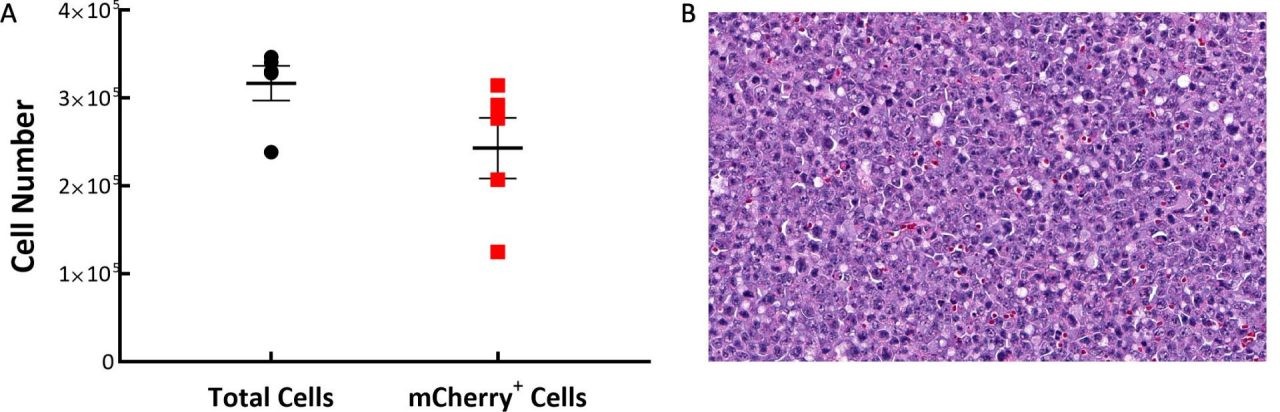
Abb. 1: C1498-Luc-mCherry-Tumorzusammensetzung in C57BL/6-Mäusen. A: Tumoren bestehen meist aus mCherry+-Zellen. B: Ein repräsentativer H&E-gefärbter Schnitt, der neoplastische Zellen mit pleomorphen Kernen und multiplen mitotischen Figuren zeigt, 20X Originalvergrößerung.
C1498-Luc-mCherry-Reaktion auf Cyclophosphamid
Um die Empfindlichkeit des C1498-Luc-mCherry-Tumormodells gegenüber Cyclophosphamid zu bestätigen, testeten wir das Breitband-Chemotherapeutikum, das zur Behandlung verschiedener Krebsarten einschließlich Leukämie eingesetzt wird, an Mäusen mit etablierter Erkrankung. Die Behandlung mit 100mg/kg führte zu einer vollständigen Regression und 90 % (9/10) tumorfreien Überlebenden (TFS, Abb. 2). Obwohl wir eine Remission sahen, zeigten die mit Cyclophosphamid behandelten Tiere bei der Nekropsie vergrößerte Eierstöcke und Eierstockhorn, verfärbte Milz und Flüssigkeit im Bauchfell. Es ist bekannt, dass die Zytotoxizität auf Cyclophosphamid-Behandlung bei Patienten mehrere unerwünschte Nebenwirkungen hat, einschließlich Knochenmarkunterdrückung, hämorrhagische Zystitis, erhöhte Anfälligkeit für Infektionen, Unfruchtbarkeit und das karzinogene Risiko der Entwicklung anderer bösartiger Erkrankungen. Die schwere Toxizität der Chemotherapie hat dazu beigetragen, den Weg zur Erforschung alternativer therapeutischer Ansätze wie z. B. Immuntherapien zu ebnen.
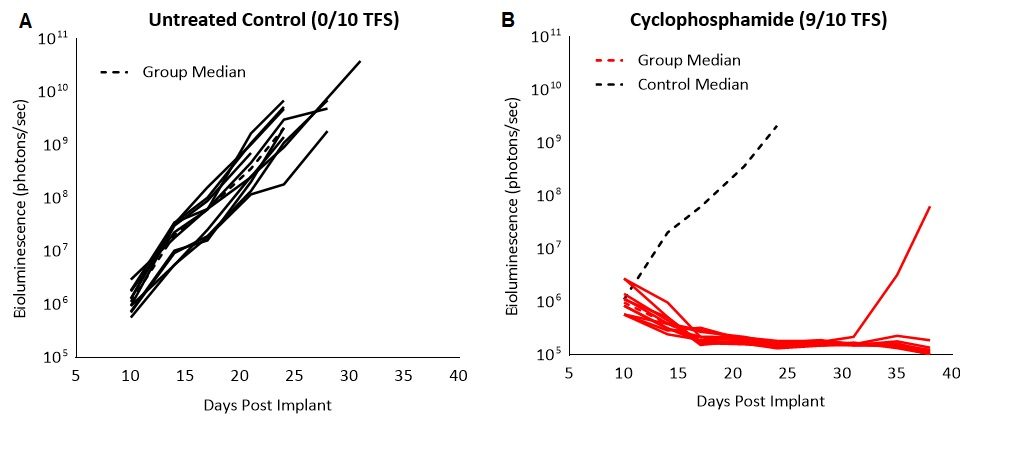
Abb. 2: C1498-Luc-mCherry-Reaktion auf Cyclophosphamid-Behandlung bei C57BL/6-Mäusen. A und B: Biolumineszenz-Signal von jeder einzelnen Maus im Zeitverlauf. Die gestrichelte schwarze Linie zeigt das Mediansignal der unbehandelten Kontrolle an.
C1498-Luc-mCherry-Reaktion auf die Blockade von Immunkontrollpunkten
Zuvor veröffentlichte Daten zeigten, dass das C1498-Modell PD-L1 in-vivo exprimierte und die Blockade mit anti-PD-L1-Antikörper die Überlebensrate verbesserte.[4] In unserer Studie evaluierten wir die Reaktion des C1498-Luc-mCherry-Modells auf anti-mPD-1 und anti-mPD-L1-Immunkontrollpunkt-Inhibitoren bei C57BL/6-Mäusen mit etablierter Erkrankung. Die Behandlung mit anti-mPD-1 oder anti-mPD-L1 führte zu einer bescheidenen Tumorwachstumsverzögerung (3 und 5,2 Tage, ohne den Ausreißer in der Anti-PD-L1-Gruppe) und erhöhte die Lebensdauer (25 % bzw. 16,7 %, Abb. 3 und 4). Behandlungsbedingte unerwünschte Wirkungen auf das Körpergewicht wurden nicht beobachtet, jedoch führte die Akkumulation des Aszites mit Fortschreiten der Krankheit in allen Gruppen zu einer Dehnung des Abdomens. Die Nekropsie zeigte Massen in den Eierstöcken, eine fleckige Leber und vergrößerte Lymphknoten.
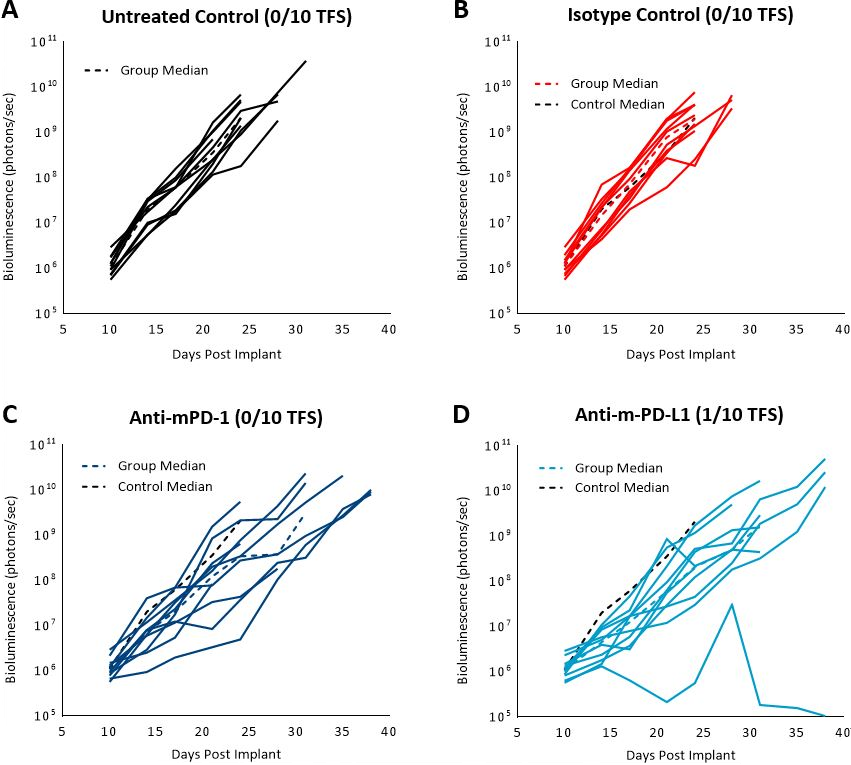
Abb. 3: C1498-Luc-mCherry-Reaktion auf Checkpoint-Inhibitoren in C57BL/6-Mäusen. A, B, C und D: Biolumineszenz-Signal von jeder einzelnen Maus über die Zeit. Die gestrichelte schwarze Linie zeigt das Mediansignal der unbehandelten Kontrolle an. Die farbigen gepunkteten Linien zeigen das Mediansignal jeder Gruppe an.
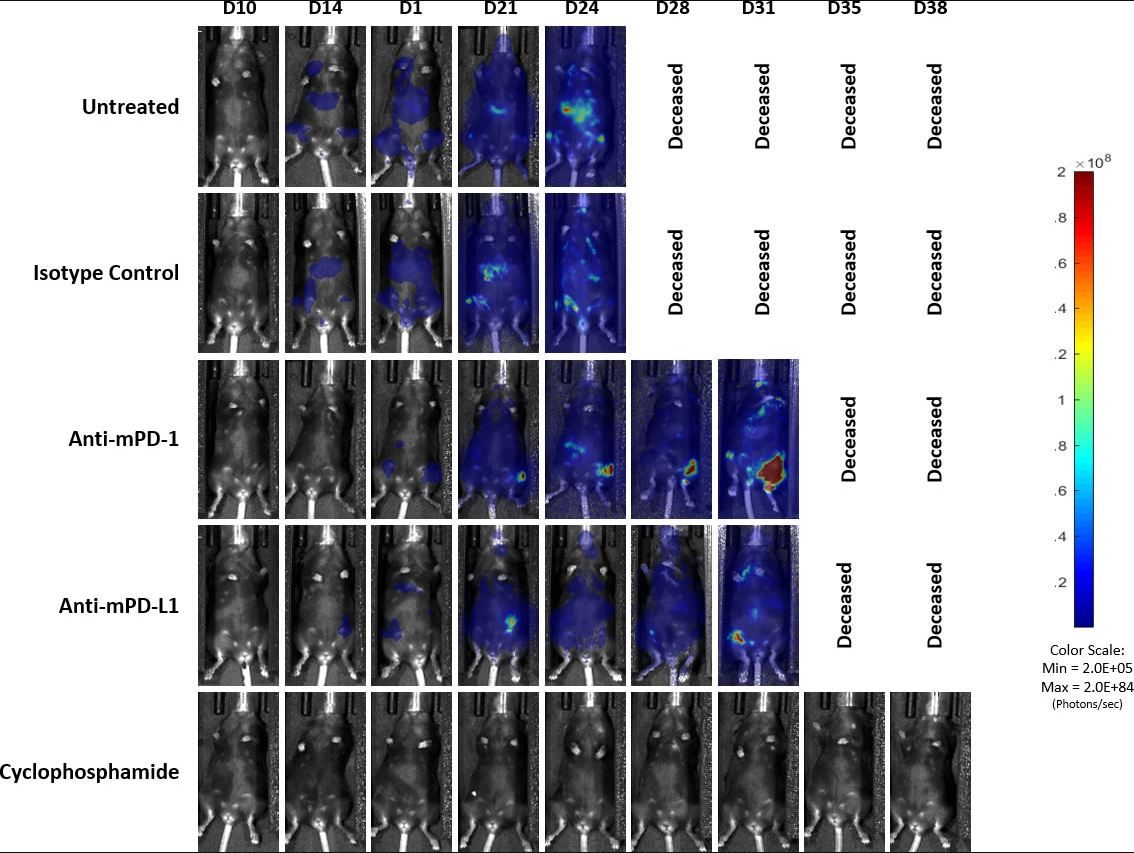
Abb. 4: Repräsentative Bilder des BLI-Signals im C1498-Luc-mCherry-disseminierten Modell in C57BL/6-Mäusen
Vorläufige klinische Studienberichte über die AML-Immuntherapie mit PD-1/PD-L1-Blockade haben gezeigt, dass eine erfolgreiche Reaktion auf die immunmodulierenden Wirkstoffe, wie bei vielen Krebsarten, nur bei bestimmten Untergruppen von AML-Patienten zu beobachten ist.[5] Im Allgemeinen wird die Monotherapie mit Immunkontrollpunkt-Hemmern bei der AML bei Patienten mit mehr als minimaler Erkrankung als unwirksam erachtet, da die Krankheit schnell fortschreitet, das Fenster für das Ansprechen klein und der Tumor heterogen ist. Daher verlagert sich der klinische Schwerpunkt auf Kombinationstherapien. Da die Reaktion auf anti-mPD-1 und anti-mPD-L1 in diesem Modell minimal ist, bietet es reichlich Gelegenheit zur präklinischen Untersuchung neuartiger Wirkstoffkombinationen mit diesen immunmodulierenden Wirkstoffen.
Contact us today to discuss whether the C1498-Luc-mCherry model is right for your next AML study.
Verweise
2Barrett AJ und Le Blanc K. 2010. Immuntherapie-Aussichten bei akuter myeloischer Leukämie. Cli. Exp. Immunol. 161(2); 223-232
3Austin R, Smyth MJ und Lane SW. 2016. Nutzung des Immunsystems bei akuter myeloischer Leukämie. Crit. Rev. Oncol. Hematol. 103:62-77
4Zhang L, Gajewski TF und Kline J. 2009. PD-1/PD-L1-Interaktionen hemmen Antitumor-Reaktionen im murinen Modell der akuten myeloischen Leukämie. Blood, 114:1545-1552
Unterhalten wir uns
Kontakt