Author: Sumithra Urs, PhD | Sr. Scientist, Scientific Development
Date: December 2019
Zu den Hautkrebsarten gehören Karzinome aller Hautschichten, wobei Basalzellkarzinome (BCC) und Plattenepithelkarzinome (SCC) die häufigsten sind. Melanome und nicht melanomartige Hautkrebsarten (Merkelzellkarzinom, Kaposi-Sarkom, kutanes Lymphom und andere Sarkome) sind viel seltener. Von allen Hautkrebsarten ist das Melanom eine ernste Form von Hautkrebs, die in den Melanozyten beginnt, den melaninproduzierenden Neuralleisten-abgeleiteten Zellen, die sich in der untersten Schicht (dem Stratum basale) der Epidermis der Haut befinden. Während maligne BCC und SCC selten metastasierend sind, ist das seltenere Maligne Melanom dagegen sehr aggressiv und breitet sich rasch auf andere Körperteile aus. Melanome kommen in vielen verschiedenen Formen, Größen und Farben vor und weisen zahlreiche unterschiedliche Warnzeichen auf[1]
Ein Melanom ist heilbar, wenn es früh erkannt und behandelt wird, mit einer 98 Prozent geschätzten Fünf-Jahres-Überlebensrate für US-Patienten.[2] Sobald ein Melanom in die Haut oder andere Körperteile eindringt, ist es schwieriger zu behandeln und kann tödlich verlaufen. Die American Cancer Society schätzt, dass in den Vereinigten Staaten 2019 etwa 192.310 neue Melanome diagnostiziert werden, von denen 96.480 Fälle invasiv sein werden und etwa 7.230 Menschen voraussichtlich an einem Melanom sterben werden. Die Raten des Melanoms sind in den letzten Jahrzehnten rapide angestiegen, und das Melanom ist eine der häufigsten Krebsarten bei jungen Erwachsenen (insbesondere bei jungen Frauen). Eine helle Hautfarbe ist ein Hauptrisikofaktor für ein Melanom, das bei Weißen 20 mal häufiger vorkommt als bei Afroamerikanern, obwohl keine Bevölkerungsgruppe immun ist. Das Risiko für jede Person kann durch verschiedene Faktoren beeinflusst werden, darunter Sonnenexposition, UV-Licht, Muttermale, frühere Krebserkrankungen sowie genetische und familiäre Faktoren.
Die Behandlungsmöglichkeiten hängen vom Stadium der Erkrankung, der Lage des Tumors und dem allgemeinen Gesundheitszustand des Patienten ab und umfassen die chirurgische Entfernung des Melanoms, Immuntherapie, gezielte Therapie, Chemotherapie und Bestrahlung. Häufig eingesetzte Einzelwirkstofftherapien zielen auf Mutationen im B-RAF-Gen, im C-KIT-Gen und anderen abnormen Genen ab. Darüber hinaus können Chemotherapeutika wie Dacarbazin, Temozolomid, nab-Paclitaxel, Cisplatin und Carboplatin eingesetzt werden. Klinische Studien mit Immuntherapeutika wie IL-2, Ipilimumab (CTLA-4-Inhibitor) sowie Pembrolizumab und Nivolumab (PD-1-Inhibitoren) sind im Gange und werben aktiv Patienten an. Diese immunmodulierenden Wirkstoffe werden auch in der Kombinationssituation sowie in neo-adjuvanten Ansätzen getestet. Darüber hinaus werden Melanom-Impfstoffe, BCG-Impfstoffe für Melanome im Stadium III und onkolytische Viren (T-VEC) getestet.[3] Neue Behandlungsmöglichkeiten konzentrieren sich auf die Verbesserung der Lebensqualität und die Erhöhung der Überlebensraten von Patienten mit fortgeschrittenem Melanom.
Das murine B16 Melanommodell ist das für präklinische Studien am häufigsten verwendete Modell des metastasierenden Melanoms. We have established the syngeneic B16-F10 model to evaluate responses to immuno-oncology agents and support development of novel therapeutics. Die B16-F10-Zelllinie wurde als der 10. serielle Passage-Subklon der B16-Elterntumorlinie in C57BL/6-Mäusen generiert.[4] In-vitro wachsen diese Zellen als eine adhärente Population, die eine epitheliale Morphologie annimmt. In-vivo führt die intradermale Implantation von B16-F10-Zellen in C57BL/6-Mäuse zu aggressiv wachsenden Tumoren. Unsere Wachstumsstudien zeigen eine effiziente Wachstumskinetik nach einer Reihe von Inokula mit einer Verdopplungszeit von etwa 2 bis 3 Tagen (Abb. 1). Kontrolltiere bleiben 20 bis 25 Tage in der Studie, bevor sie das Euthanasiekriterium der übermäßigen Tumorbelastung erreichen. Daraus ergibt sich ein Modell, das ein bis zu zweiwöchiges Dosierungsfenster für Test-Agenzien ermöglicht, um deren Anti-Tumor-Aktivität auszulösen. Während das Modell selbst nicht zu einer Körpergewichtsverringerung führt, sind Tumorverschorfung und Ulzerationen häufige klinische Symptome, die mit subkutanem und intradermalem B16-F10-Tumorwachstum assoziiert sind.
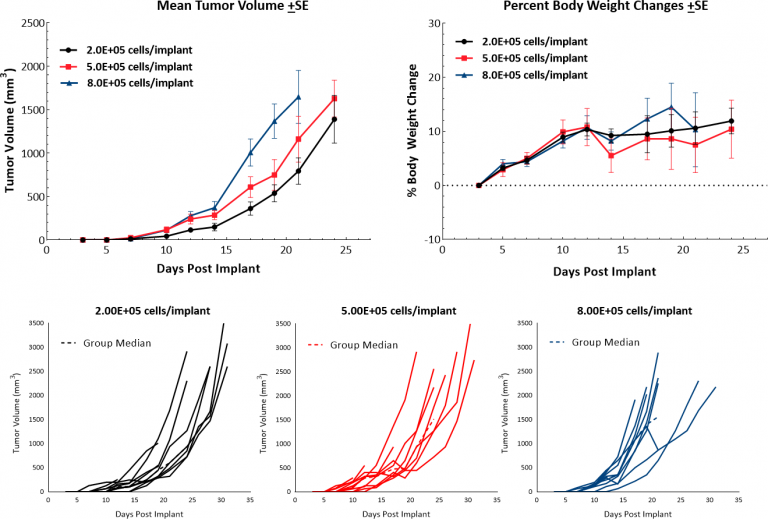
Abb. 1: Wachstumskinetik und Körpergewichtsveränderung nach intradermaler Implantation von B16-F10 in C57BL/6 Mäuse.
B16-F10 Tumor-Immunprofil
Baseline immune profiling of B16-F10 tumor infiltrates was determined by flow cytometry on 5 untreated tumors (300-500mm3) and analyzed using the CompLeukocyteTM package. The immune cell infiltration in the tumor microenvironment, represented a percent of CD45+ cells, showed a distinct immune cell population dominated mostly by undefined CD11b+ myeloid cells characteristic to this tumor model (Fig 2). Die M2 TAM (19 %), G-MDSC (15 %) und M-MDSC (11 %) waren relativ anteilig vertreten, während M1 TAM (1,4 %) und dendritische Zellpopulationen (4 %) nur minimal vertreten waren. Die lymphoide Population bestand hauptsächlich aus B- (7,3 %) und NK-Zellen (4 %) mit minimaler T-Zell-Infiltration in die Tumore. Das Gesamtimmunprofil lässt auf ein nicht-immunogenes Modell schließen.
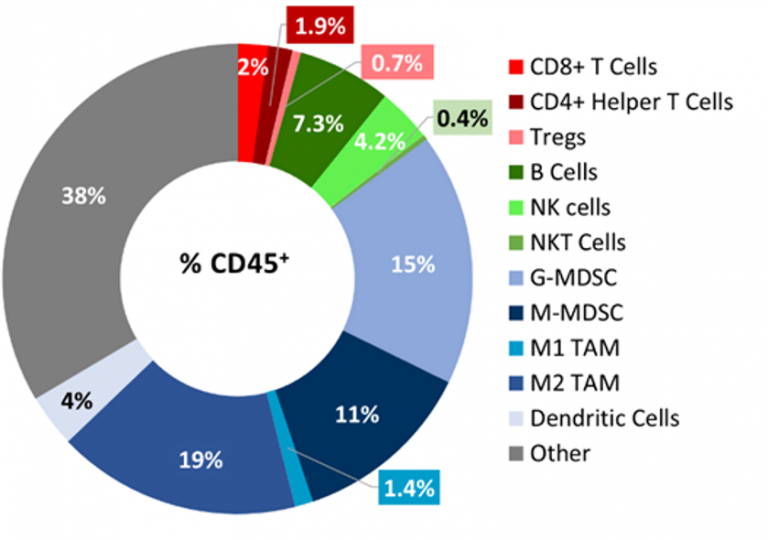
Abb. 2: Immunphänotypisierung von Tumor-Immunzell-Infiltraten im B16-F10 Modell.
B16-F10 Ansprechen auf Therapie
Immunmodulatoren:
We have investigated a number of immune modulatory antibodies in this model. Beginn der Behandlung, als die Tumoren ~90 mm3 mit den Checkpoint-Inhibitoren anti-mPD-1 oder anti-mPD-L1 erreichten, führte bei subkutanen B16-F10-Tumoren zu keinem Ansprechen (Abb. 3A). Auch der Beginn der Behandlung mit anti-mCTLA-4 oder anti-mLAG-3 bereits vier Tage nach der Implantation führte zu keiner Reaktion (Abb. 3A). Schließlich konnten wir auch keine Anti-Tumor-Aktivität feststellen, als B16-F10-Tumore mit dem co-stimulatorischen Rezeptor CD137 der TNF-Rezeptorfamilie behandelt wurden (Abbildung 3B). Angesichts der immunsuppressiven Tumor-Mikroumgebung von naiven B16-F10-Tumoren ist es nicht überraschend, dass Immunmodulatoren mit einer einzigen Substanz eine begrenzte/keine Reaktion hervorrufen, und diese fehlende Reaktion legt ein immunologisch kaltes Tumormodell nahe, wie es für B16-F10 berichtet wurde.
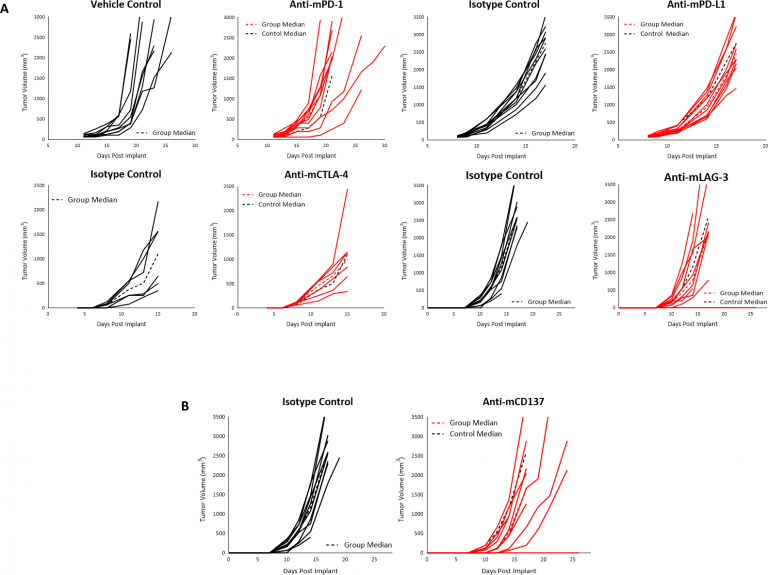
Abb. 3: Antwort von B16-F10 Tumoren nach Behandlung mit Checkpoint-Inhibitoren (A), oder Anti-mCD137 (B), in C57BL/6 Mäusen.
Bestrahlung:
Strahlentherapie (RT) wird bei Melanomfällen eingesetzt, bei denen die Patienten keine guten Kandidaten für eine Operation sind oder eine chirurgische Behandlung ablehnen. Wir evaluierten die Empfindlichkeit von subkutanen B16-F10-Tumoren gegenüber einer einzelnen Dosis fokaler Strahlung, die von der Small Animal Radiation Research Platform (SARRP) von Xstrahl abgegeben wurde. Strahlungsbehandlungen von entweder 10, 15 oder 20 Gy zeigten Anti-Tumor-Aktivität bei mindestens 50 % der Tiere, was zu einer Dosisansprechverzögerung des Tumorwachstums von 5.9, 14 oder 10,5 Tagen für 10, 15 und 20 Gy RT führte, was jeweils anzeigt, dass das Melanommodell B16-F10 auf Bestrahlung anspricht (Abb. 4). Doch selbst die Behandlung mit der höchsten getesteten Dosis führte weder zu einer signifikanten Regression noch zu tumorfreien Überlebenden. Daher könnte die Verwendung von fokaler RT durch SARRP in der Präklinik bei der Evaluierung von Kombinationsansätzen zur Nachahmung klinischer Entwicklungspfade nützlich sein, die eine Strahlenbehandlung einschließen.
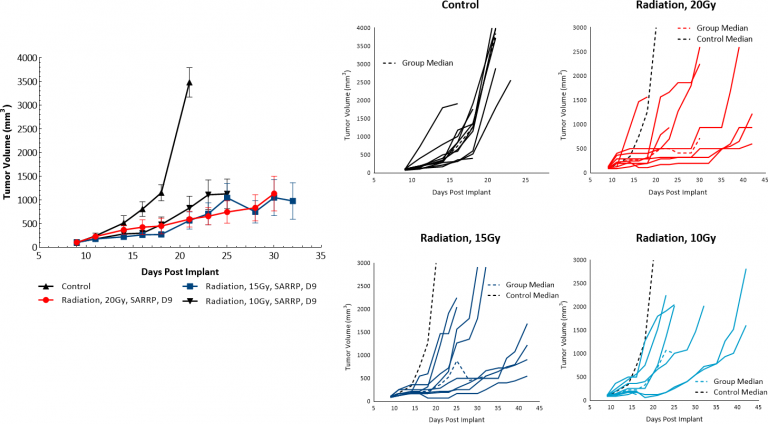
Abb. 4: Antwort von B16-F10 Tumoren auf fokale Bestrahlung bei C57BL/6 Mäusen.
Behandlungsoptionen für Melanompatienten unter Verwendung von Kombinationsansätzen mit immunmodulatorischen Wirkstoffen und Chemotherapie oder Strahlentherapie sind potenzielle Wege, um das Ansprechen der Patienten zu verbessern.[5] Darüber hinaus kann die Kombinationsbehandlung auch dazu beitragen, die immunologisch kalte Natur des Tumors in Richtung einer rezeptiveren/reagierenden Tumor-Mikroumgebung zu verändern, die für die Therapie leichter zugänglich sein würde. To discuss how the B16-F10 model would be useful in your next immunotherapy study, contact the scientists.
Verweise
1https://www.skincancer.org/skin-cancer-information/melanoma/melanoma-warning-signs-and-images/.
2SEER Cancer Stat Facts. National Cancer Institute, NIH (https://www.cancer.gov).
3NCI melanoma clinical trials (https://www.cancer.gov/about-cancer/treatment/clinical-trials/disease/melanoma).
4Nakamura K et al. Charakterisierung von Melanomzelllinien der Maus durch ihre tödliche Malignität mittels eines experimentellen metastatischen Modells. Life Sci. 2002 Jan 4;70(7):791-8. DOI: 10,1/s0024-3205(01)01454-0.
5Schwartz AL et al. Das Antisense-Targeting von CD47 erhöht die menschliche zytotoxische T-Zell-Aktivität und erhöht das Überleben von Mäusen, die ein B16-Melanom tragen, wenn es mit Anti-CTLA4 und Tumorbestrahlung kombiniert wird. Cancer Immunol Immunother. 2019 Oct 18. DOI: 10,1/s00262-019-02397-7.
Unterhalten wir uns
Kontakt