Datum: September 2020
Die Biolumineszenz-Bildgebung (BLI) ist eine nicht-invasive optische Bildgebungsmodalität zur Visualisierung und Quantifizierung des Biolumineszenzsignals in Geweben.1 BLI basiert auf dem Nachweis von sichtbarem Licht, das während der enzymvermittelten Oxidation eines Substrats erzeugt wird, wenn das Enzym in-vivo als Molekularreporter exprimiert wird.
BLI bietet eine robuste, sensitive und durchsatzstarke Alternative zu traditionelleren Bildgebungs- und Biodistributionsstudien, die terminale Endpunkte, invasive Verfahren oder Radiomarkierung verwenden. We were the first CRO to offer BLI in 2003 and in the 17 years since we have amassed considerable experience and know-how in this optical imaging field. In diesem Technologie-Spotlight werden wir die Prinzipien der Biolumineszenz-Bildgebung vorstellen und die Vorteile dieses präklinischen Services bei der Krebserkennung, der Überwachung des Krankheitsverlaufs und der In-vivo -Antitumor-Wirksamkeitsbewertung beleuchten.
BLI benötigt Zellen zur Expression von Luciferase, einem Wort, das sich vom lateinischen Luzifer–Lichtbringer ableitet, die zum Beispiel von Glühwürmchen oder der Oktokoralle Renilla reniformis produziert wird. Das luc-Gen des Glühwürmchens wurde zuerst im Jahr 19852 geklont, und seitdem ist Grün das am häufigsten verwendete Fluoreszenz-Farbbild. Glühwürmchen-Luciferase erfordert die Injektion ihres Substrats, D-Luciferin, das ein Biolumineszenzsignal mit Spitzenwert bei 562 nm erzeugt. Dies wird von einer CCD-Kamera (Charged Coupled Device) mit hoher Quanteneffizienz in einem lichtdichten Gehäuse eingefangen. The sequence of events leading from engineering tumor cells to express luciferase to imaging animals in vivo is illustrated in Figure 1. We use IVIS® In Vivo Imaging Systems (PerkinElmer, Waltham, MA) which allow high sensitivity and high resolution in vivo BLI and fluorescence imaging (FLI) across a wide range of wavelengths. Bis zu fünf Tiere auf einmal werden unter 2 % Isoflurangas-Anästhesie abgebildet. Jeder Maus wird D-Luciferin injiziert, und sie wird 10–15 Minuten nach der Injektion abgebildet. Das BLI-Signal wird in Regions of Interest (ROI) quantifiziert, die um Tumore, bestimmte Bereiche (z. B. kranial, thorakal oder abdominal), den ganzen Körper oder Gewebe ex-vivo herum gezeichnet werden, und das Signal wird in Photonen pro Sekunde ausgedrückt, die den Fluss darstellen, der omnidirektional von der benutzerdefinierten Region ausstrahlt. Bilder werden mit der Software Living Image 4.3.1 (PerkinElmer, Waltham, MA) analysiert.
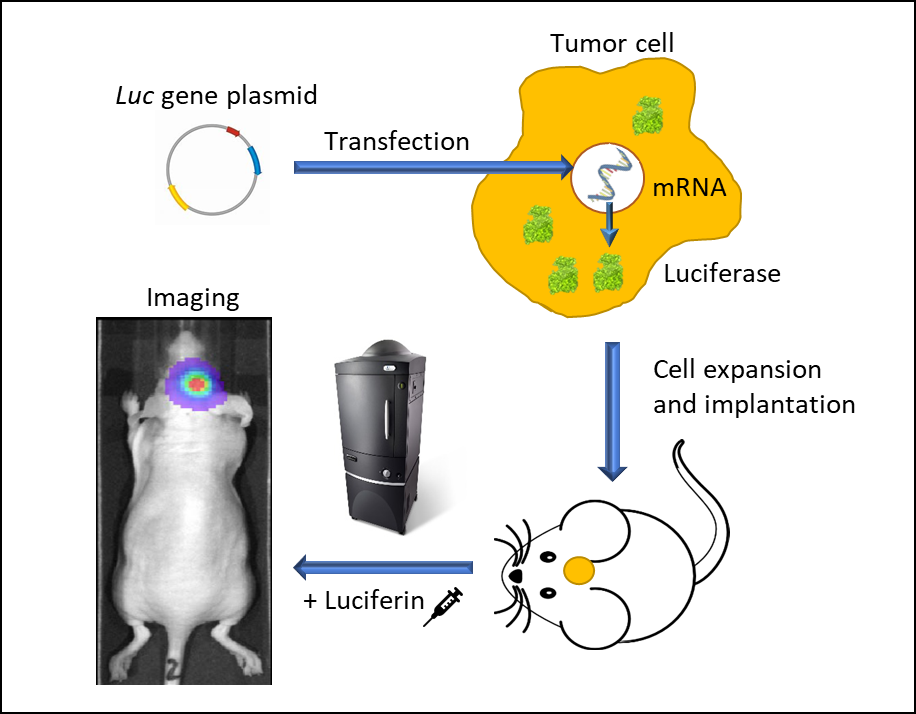
Abbildung 1: In-vivo-Biolumineszenz-Bildgebung mit lumineszierenden lebenden Zellen. Ein Vektor, der ein Promotor-getriebenes luc-Gen trägt, wird in eine Tumorzelle transfiziert. Stabil transfizierte Zellen werden expandiert und in eine Maus implantiert. Nach dem Tumorwachstum wird dem Tier Luziferin injiziert und es wird unter Narkose in einem IVIS-Bildgebungssystem abgebildet. Luc-Zellen emittieren Licht und können räumlich-zeitlich verfolgt werden.
Überwachung des orthotopischen Wachstums solider Tumore
In den letzten 20 Jahren haben die Wirksamkeit und Empfindlichkeit der BLI-Methoden und -Werkzeuge zu einem immer breiteren Katalog von Anwendungen geführt: Untersuchungen von Protein-Protein-Interaktionen, genetisches Screening, Zellzyklus-Regulatoren, parasitäre Infektionen, Verfolgung der Stammzelltransplantation, NK-Zellmigration und, vor allem, präklinische Onkologie. Eine signifikante Anzahl von Studien hat gezeigt, dass die BLI-Bildgebung in der Lage ist, die zeitliche Entwicklung von Tumoren zu beurteilen.3 Dies ist besonders kritisch, wenn man das Tumorwachstum nicht durch Dickenmessungen bestimmen kann und sich stattdessen auf klinische Anzeichen wie Gewichtsverlust oder die Beurteilung der Tumorlast nach der Euthanasie der Tiere verlassen muss. In den unten gezeigten Beispielen wurde die Tierpflege und -verwendung gemäß den Tierschutzbestimmungen in einer AAALAC-akkreditierten Einrichtung mit Überprüfung und Genehmigung des IACUC-Protokolls durchgeführt.
Beispiele, die den Wert der nicht-invasiven BLI bei der Überwachung der Entwicklung von Tumoren im tiefen Gewebe hervorheben, sind in Abbildung 2 dargestellt. NCI-H460-Luc2-humane Lungenkarzinom-Xenografts wurden orthotopisch (OT) (1x105 Zellen/Maus) in die linke Lunge weiblicher Nacktmäuse implantiert. BLI (Abbildung 2, oben links) zeigen Tumoren in der Brusthöhle, die bereits 8 Tage nach der Tumorzellenimplantation nachweisbar sind (im Bild nicht sichtbar aufgrund der Schwellenwertbildung auf das an Tag 28 gesehene maximale Signal) und eine zunehmende Tumorlast über die nächsten 2 Wochen. Die Mäuse erlitten während der gesamten Studiendauer einen mittleren prozentualen Körpergewichtsverlust von 18,3 %, der wahrscheinlich krankheitsbedingt war (nicht gezeigt) und wurden 28 Tage nach der Tumorzellenimplantation eingeschläfert. Die Nekropsie zeigte ein signifikantes Wachstum des Primärtumors und eine erhebliche Entwicklung von Massen in der gesamten Brusthöhle. In Abbildung 2, unten links, wurden weibliche Albino- C57BL/6-Mäuse intrakraniell mit GL261-luc2 syngenen murinen Gliomzellen (1x106 Zellen/Maus) implantiert. Die Tumore waren in den Gehirnen 7 Tage nach der Implantation nachweisbar. Gewichtsverlust im Zusammenhang mit dem Fortschreiten der Erkrankung ist in diesem Modell häufig und war 11 Tage nach der Tumorimplantation nachweisbar, während der mediane Todeszeitpunkt etwa 21 Tage betrug. Die humane Brust-Adenokarzinom-Zelllinie MDA-MB-231-luc-D3H2LN bildet Knochenläsionen nach intrakardialer Injektion (1x105 Zellen/Maus) bei weiblichen Nacktmäusen. Knochenläsionen waren 21 Tage nach der Tumorzellinjektion deutlich sichtbar, und sowohl die Anzahl der Tumore als auch die Gesamttumorlast nahmen in den nächsten 3 Wochen zu (Abbildung 2, rechts, oben und unten). Mäuse erfuhren einen maximalen Gewichtsverlust von 16,2 % bis zum Tag 32. Der Körpergewichtsverlust hing weitgehend mit der Aggressivität des Modells zusammen (nicht gezeigt). Die mitzunehmende Botschaft dieser Studien ist, dass BLI ein leistungsfähiges Instrument zur Untersuchung einer Vielzahl von Tumorarten in Echtzeit und nicht-invasiv sein kann, ohne sich allein auf klinische Krankheitszeichen verlassen zu müssen, die mit einer zunehmenden Tumorlast einhergehen können oder auch nicht.
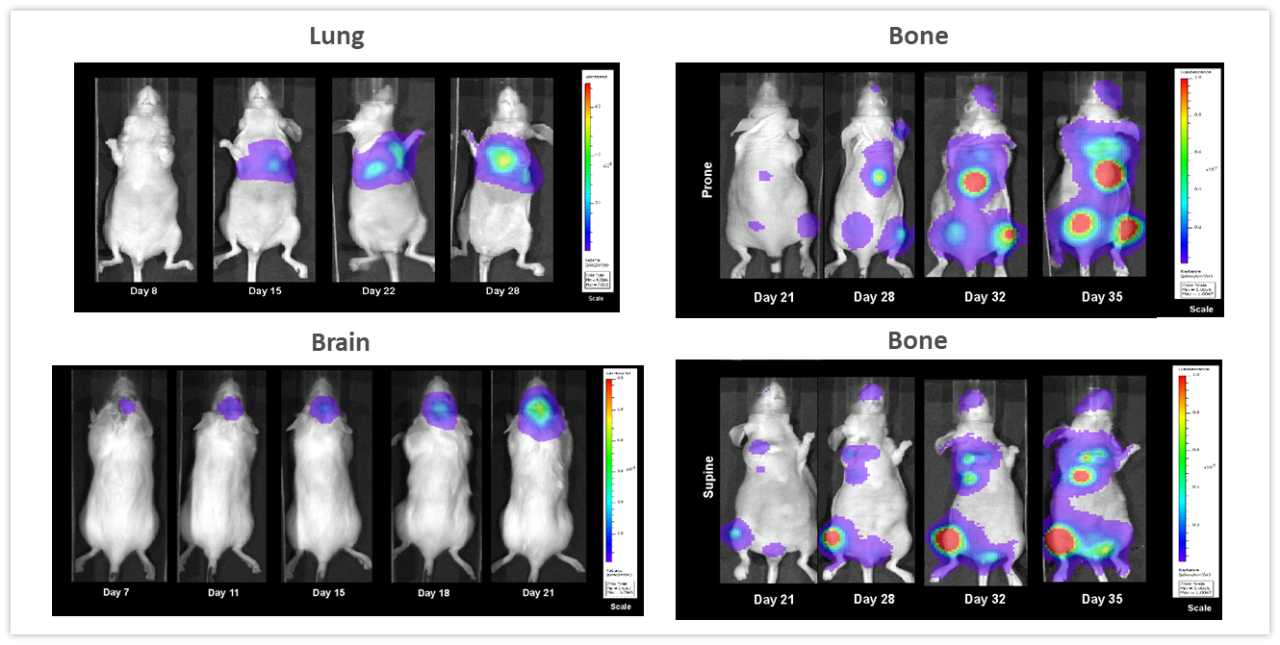
Abbildung 2: Repräsentative BLI-Bilder über mehrere In-vivo-Modelle hinweg. Oben links, NCI-H460-Luc2-humanes Lungenkarzinom implantiert OT (linke Lunge) bei weiblichen Nacktmäusen. Unten links, syngenes Mausgliom GL261-luc2-Zellen, die OT (Gehirn) in weibliche Albino C57BL/6-Mäuse implantiert wurden, und rechts menschlicher Brusttumor MDA-MB-231-luc-D3H2LN Knochenläsionen nach intrakardialer Injektion bei weiblichen Nacktmäusen mit Ganzkörperaufnahmen in Bauch- (oben) und Rückenlage (unten).
Bildgebung bei hämatologischen Malignomen
With over 80 unique hematological malignancy cell lines, we lead the industry with market-relevant hematologic malignancy models, particularly pertinent in the adoptive cell therapy (ACT), also known as cellular immunotherapy, field.4 BLI is critically valuable when evaluating progression and treatment response in hematological disseminated malignancies. Längsschnittstudien, die an 4 verschiedenen menschlichen hämatologischen Krebszellen durchgeführt wurden, die in NSG-Mäuse intravenös injiziert wurden, zeigten in allen Modellen eine erhöhte Tumorlast im Zeitverlauf (Abbildung 3), was den Wert von BLI bei der wiederholten Beurteilung des Krankheitsverlaufs und der Schwere der Erkrankung sowie beim Verständnis der Biodistribution des Tumorsignals im gesamten Körper unterstreicht.
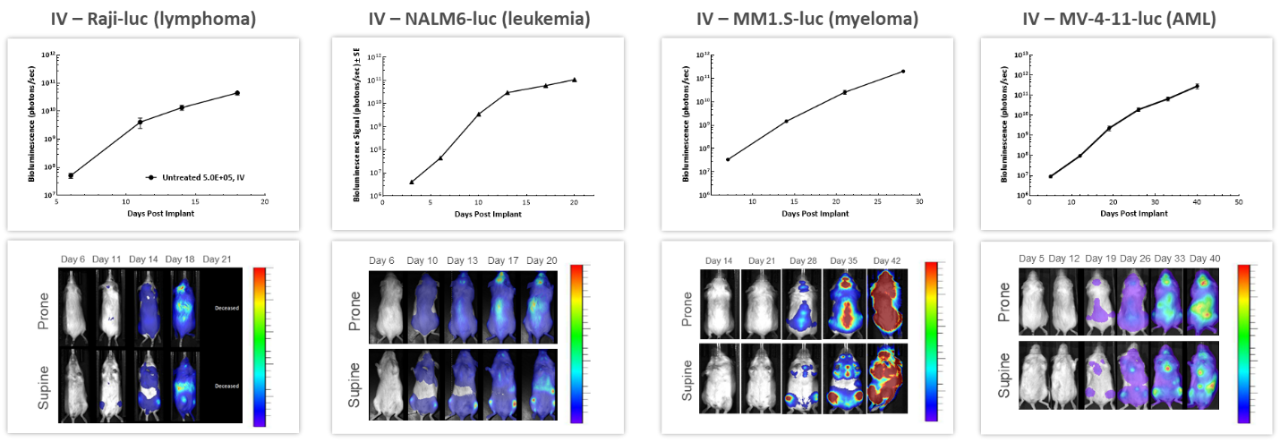
Abbildung 3: Repräsentative BLI-Daten über mehrere in-vivo humane hämatologische Malignome nach IV-Injektion bei NSG-Mäusen.
ACT entwickeln sich ständig weiter und bieten den Patienten bessere und individuellere Optionen. CAR-T-Zellen sind autologe oder allogene T-Zellen, die spezifisch auf durch Tumorzellen exprimierte Antigene oder Marker abzielen. Die präklinische In-vivo-Beurteilung der Wirksamkeit und Sicherheit von CAR-T-Zellen ist unerlässlich, bevor eine Umsetzung dieser neuen Therapien in der Klinik erfolgt. Die in Abbildung 4 gezeigte Studie wurde konzipiert, um verschiedene CAR-T-Präparationen und -Dosen an menschlichen Raji-luc-B-Zell-Lymphomzellen zu testen, die intravenös in NSG-Mäuse implantiert wurden. Die 3 verschiedenen CAR-T-Konstrukte hemmten signifikant die Tumorlast und verlängerten das Überleben, was den Wert von BLI für die Entwicklung dieser neuen zellulären Immuntherapien verdeutlicht.
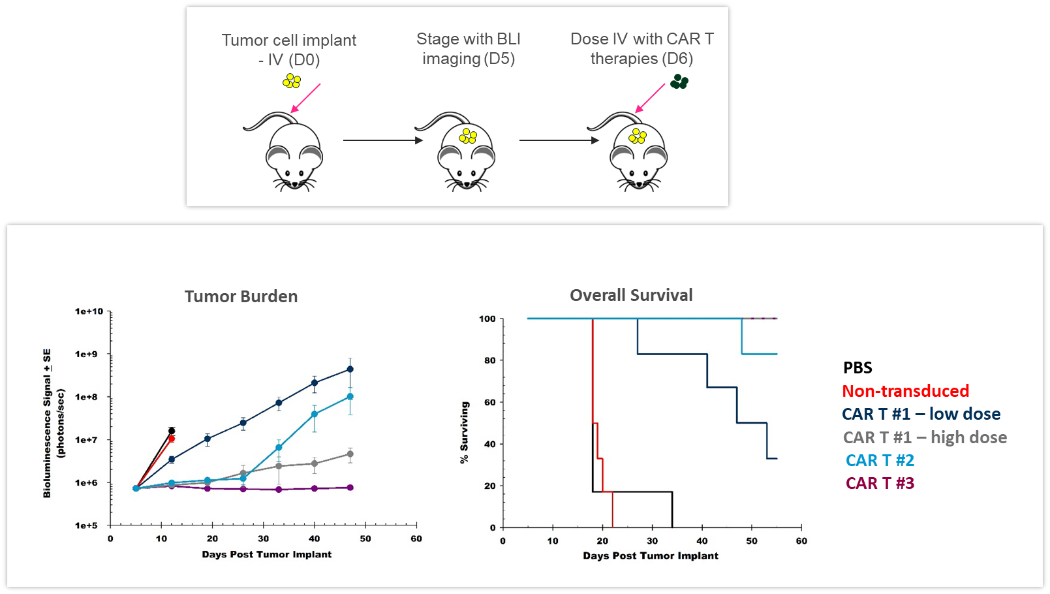
Abbildung 4: Wirkung der CAR-T-Therapie gegen humanes Raji-luc B-Zell-Lymphom, das intravenös in NSG-Mäuse implantiert wurde. Oben: Schematische Darstellung der Tumorzell-Inokulation und CAR-T-Therapie. Unten: Tumorlast nach BLI und Gesamtüberleben.
Überwachung der Behandlungswirksamkeit
Strahlung
Offensichtlich liegt einer der Hauptvorteile von BLI in der Fähigkeit, die Wirksamkeit von Anti-Tumor-Therapien über die Zeit bei ein und demselben Tier zu verfolgen, was zu einer Verringerung der Anzahl der verwendeten Tiere führt. In dem in Abbildung 5 gezeigten Beispiel wurde weiblichen Nacktmäusen intrakraniell ein NCI-H1975-luc-humanes, nicht-kleinzelliges Lungenkarzinom implantiert, um Lungenmetastasen im Gehirn nachzuahmen. Die Mäuse erhielten zwei Serien fraktionierter Strahlung (2 Gy; 5 Tage an, zwei Tage aus für zwei Zyklen), die von einem RadSource RS-2000-Bestrahler abgegeben wurden. Die Kontrollgruppe wurde scheinbestrahlt. BLI-Bilder wurden über die Zeit aufgenommen und zeigten, dass die Bestrahlung die Tumorlast signifikant reduzierte (Abbildung 5, p<0,05 an Tag 19) und die Lebensdauer um 160 % erhöhte (p<0.05, nicht gezeigt). In diesem Experiment waren wir in der Lage, das Ansprechen auf die Behandlung in-vivo zu quantifizieren, was für die Überwachung der Wirksamkeit sowie für die Entwicklung und Verfeinerung neuer therapeutischer Ansätze von großer Bedeutung ist.
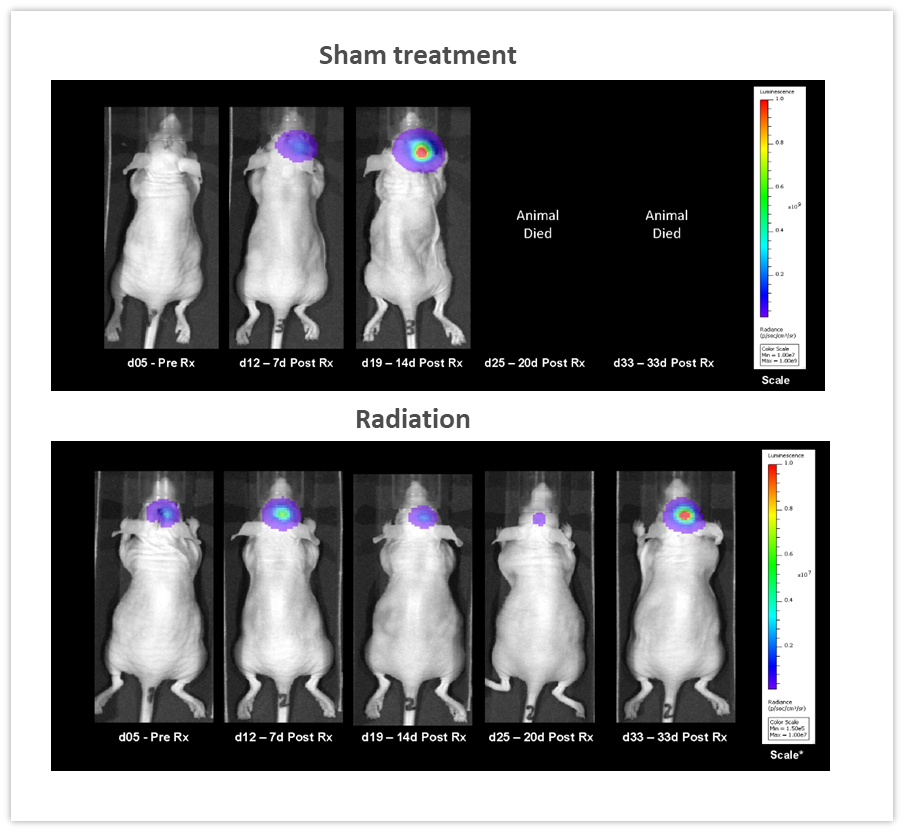
Abbildung 5: Wirkung einer lokalisierten Strahlenbehandlung (2 Gy; 5 Tage an, zwei Tage aus für zwei Zyklen) gegen intrakraniell implantiertes NCI-H1975-luc- humanes, nicht-kleinzelliges Lungenkarzinom bei weiblichen Nacktmäusen.
Checkpoint-Hemmung und Kombinationstherapie
Die Wirkung der Checkpoint-Hemmung, allein oder in Kombination mit Bestrahlung, wurde an syngenen GL261-luc2-Gliomzellen der Maus getestet, die intrakraniell in weibliche Albino-C57BL/6-Mäuse implantiert wurden. Die Mäuse wurden unbehandelt gelassen, mit Strahlung behandelt und von der Small Animal Radiation Research Platform (SARRP; Xstrahl Inc.) mit einer einzigen 7,5-Gy-Dosis, Anti-Maus-PD-1 (Klon RMP1-14, 10 mg/kg) oder in Kombination beider Therapien bereitgestellt. Wie in Abbildung 6 dargestellt (links) war das BLI-Signal bereits 6 Tage nach der Implantation der Tumorzellen nachweisbar und schritt in den nächsten Wochen voran. Die Quantifizierung des resultierenden Biolumineszenzsignals (rechts) zeigte die Wirkung der Behandlungen auf die Tumorlast. Die Anti-mPD-1-Behandlung führte zu einer Tumorwachstumsverzögerung von 2,6 Tagen und 1/8 tumorfreiem Überleben (TFS), während die Bestrahlung zu einer Tumorwachstumsverzögerung von 16,6 Tagen und 2/8 tumorfreiem Überleben führte. Die Kombination von Bestrahlung und Anti-mPD-1}-Behandlung führte zu einer signifikanten Verzögerung von 38,6 Tagen des Tumorwachstums und vollständiger Remission bei 7/8 der Mäuse. Traditionelle Methoden zur Messung der Anti-Tumor-Reaktion bei tief im Körper gelegenen bösartigen Tumoren basieren auf terminalen und oft zeitaufwendigen Messungen. Wie in diesen Beispielen gezeigt wird, hat die Integration von In-vivo-BLI-Bildgebung es uns ermöglicht, von einer „Black Box“ der Tumortherapie zu einer Echtzeit-Beurteilung des individuellen Ansprechens überzugehen, was uns die Flexibilität bietet, Behandlungen schneller anpassen und verfeinern zu können.
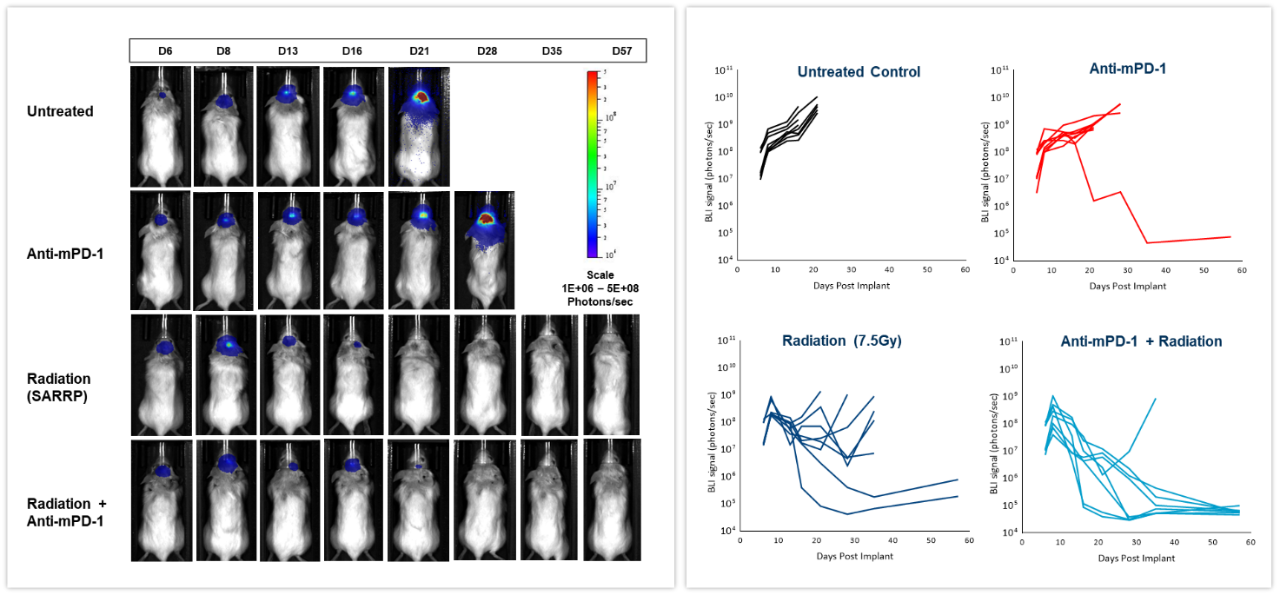
Abbildung 6: Wirkung von fokaler Bestrahlung, Anti-mPD-1- und Kombinationstherapie bei intrakraniellen GL261-luc-Tumoren bei weiblichen C57-BL/6-Albino-Mäusen.
Multimodalität
BLI kann mit anderen Bildgebungsmodalitäten gekoppelt werden, um verschiedene biologische Pfade zu untersuchen. Zur Veranschaulichung dieser Anwendung verwendeten wir syngenetische 4T1-luc2-1A4- Mausbrust-Adenokarzinomzellen, die OT in das Brustfettpolster von immunologisch kompetenten BALB/c-Mäusen injiziert wurden. Als die Tumoren ~300 mm3 erreichten, wurde ein Nah-Infrarot-Bildgebungsmittel, ProSenseTM750, intravenös injiziert, um die mit aggressivem Brustkrebswachstum verbundene Cathepsin-Aktivität nachzuweisen. ProSenseTM750 ist ein optisch stiller Wirkstoff, der bei der Spaltung mit Kathepsinen fluoresziert. Wie in Abbildung 7 dargestellt, waren BLI- und FLI-Tumorsignale in Tumoren leicht nachweisbar. Die BLI- und FLI-Signale waren jedoch nicht perfekt überlagerbar, was zu erwarten ist, da Luciferase von allen lebenden Tumorzellen produziert wird, während das Fluoreszenzsignal nicht nur auf Tumorzellen, sondern auch auf andere tumorassoziierte Zellen, hauptsächlich Makrophagen, beschränkt ist, die für die Spaltung und Aufnahme durch die ProSenseTM750 Kathepsin-Sonde verantwortlich sind. Multimodality can thus be used to interrogate different biologies in vivo, simultaneously.
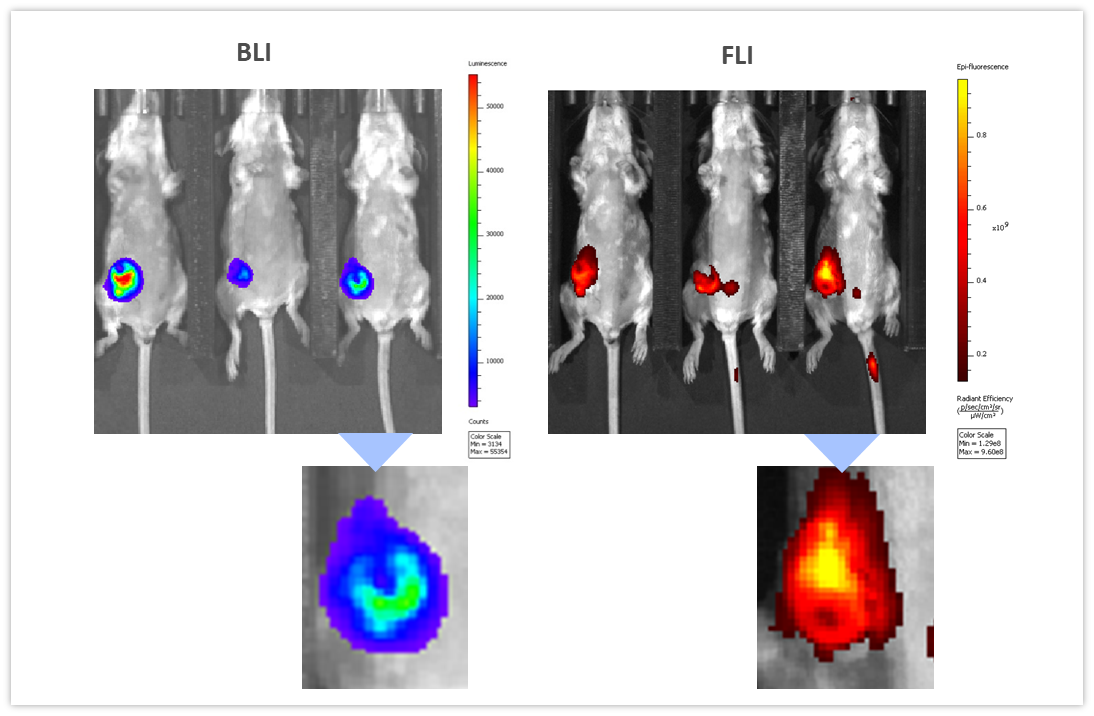
Abbildung 7: Multimodale Bildgebung von 4T1-luc2-1A4-Tumoren mittels BLI (links) und FLI (rechts) 24 Stunden nach intravenöser Injektion der Cathepsin-spezifischen ProSenseTM750-Fluoreszenzsonde. Unten sehen Sie Nahaufnahmen der entsprechenden Tumoren.
Zusammenfassung
Mausmodelle von Tiefgewebskrebs und Krebsmetastasen stützen sich zur Beurteilung der Tumorlast überwiegend auf terminale Beurteilungen wie Gewebegewicht, Knotenzahl und/oder histologische Analysen. Seit seiner Einführung vor mehr als 20 Jahren hat sich BLI zu einer unschätzbaren Technik entwickelt, um die Wachstumsdynamik von biolumineszent markierten Krebszelllinien im Zeitverlauf und in Reaktion auf verschiedene therapeutische Ansätze in-vivo zu verfolgen, wobei die Anzahl der Versuchstiere minimiert wird, da dieselben Versuchsobjekte über die Zeit abgebildet werden können, ohne dass terminale Beurteilungen erforderlich sind. BLI hat bedeutende Beiträge zu einer Vielzahl wissenschaftlicher Bereiche geleistet und darüber hinaus eine Alternative zur Verwendung etablierter invasiver oder radioisotopenabhängiger nicht-invasiver Bildgebungsmodalitäten bereitgestellt.
Contact the scientists to request the full data set or to learn more about our BLI service and how it can be applied to your preclinical research.
Verweise
1Contag CH, Spilman SD, Contag PR, Oshiro M, Eames B, Dennery P, Stevenson DK, Benaron DA. Visualizing gene expression in living mammals using a bioluminescent reporter. Photochem Photobiol 1997; 66: 523–531.
2de Wet JR, Wood KV, Helinski DR, DeLuca M. Cloning of firefly luciferase cDNA and the expression of active luciferase in Escherichia coli. Proc. Natl. Acad. Sci. U.S.A. 1985; 82, 7870–7873.
3 Jenkins DE, Oei Y, Hornig YS, Yu SF, Dusich J, Purchio T, Contag PR. Bioluminescent imaging (BLI) to improve and refine traditional murine models of tumor growth and metastasis. Clin Exp Metastasis, 2003; 20(8):733-744.
4 https://www.cancerresearch.org/immunotherapy/treatment-types/adoptive-cell-therapy
Unterhalten wir uns
Kontakt