Unterstützung Ihres Assay- und Biomarker-Bedarfs für COVID-19
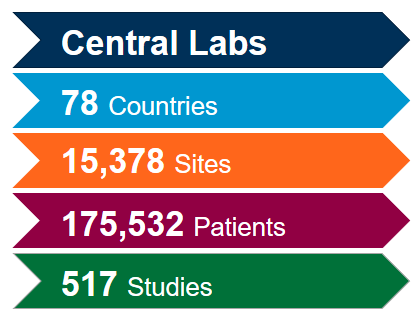
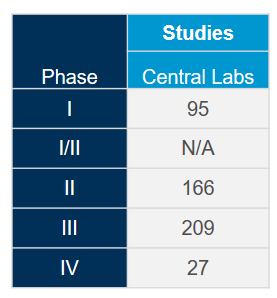
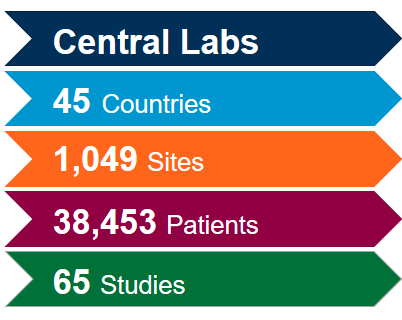
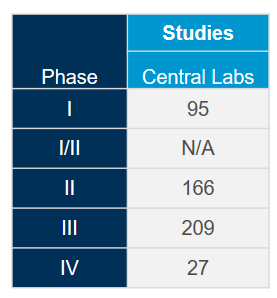
Generieren Sie den größten Mehrwert aus unserem weltweit integrierten Netzwerk von Zentrallaboren mit der Hilfe unserer wissenschaftlichen und betrieblichen Experten. Mit umfangreicher Erfahrung aus mehr als 4.400 klinischen Studien der letzten fünf Jahre in allen therapeutischen Bereichen wissen wir, wie Sie Ihre Studien optimieren und potenzielle Probleme mildern können, um der Dynamik der Coronavirus (COVID-19)-Studien gerecht zu werden.